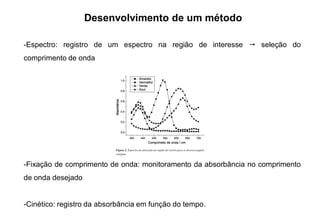
O documento descreve técnicas espectrofotométricas para análise quantitativa, incluindo registro de espectros, fixação de comprimento de onda, cinética, curva de calibração, método da adição de padrão e pontos isosbéticos. Aplicações incluem análise de misturas, íons em amostras ambientais e titulações espectrofotométricas.












![Análise de uma mistura
O que fazer quando os espectros se sobrepõem?
trabalhar com vários comprimentos de onda
SX
Y
SX
m
X
X
A
A
Y
Y
A
A
S
S
S
][
][
][
][
Inclinação Intersecção
XS = solução padrão de X
YS = solução padrão de Y
m = mistura](https://image.slidesharecdn.com/aula-4-espectrometria-uv-vis-parte-2-170213021708/85/Aula-4-espectrometria-uv-vis-parte-2-14-320.jpg)
![O que fazer quando os espectros estão bem resolvidos?
Análise de uma mistura
’
”
A’ = ’Xb[X] + ’Yb[Y]
A” = ”Xb[X] + ”Yb[Y]
se aplicam a cada espécie em cada comprimento de onda – devem ser medidos
em experimentos separados](https://image.slidesharecdn.com/aula-4-espectrometria-uv-vis-parte-2-170213021708/85/Aula-4-espectrometria-uv-vis-parte-2-15-320.jpg)

![Exercício
O quelato [AQ2]2- apresenta um máximo de absorção em 480 nm. Quando o agente
quelante está pelo menos 5 vezes em excesso, a absorbância depende apenas da
concentração molar de A2+. Uma solução 2,30x10-4 mol L-1 em A2+ e 8,6x10-3 mol L-1 em
Q2- tem absorbância de 0,690 em 480 nm e cubeta 1,00 cm. Nas mesmas condições,
uma solução que é 2,30x10-4 mol L-1 em A2+ e 5,00x10-4 mol L-1 em Q2- tem absorbância
0,540 em 480 nm. Calcule o valor de Kformação de AQ2
2-:
A2+ + 2Q2- ⇌ AQ2
2-](https://image.slidesharecdn.com/aula-4-espectrometria-uv-vis-parte-2-170213021708/85/Aula-4-espectrometria-uv-vis-parte-2-17-320.jpg)

![Ponto isosbético
][][ 465465465
InbHInbA
InHIn
Em 465nm:
cteInHIne
InHIn
][][465465
Todas as soluções contêm a mesma concentração total de vermelho de metila (= [HIn]-
[In-]). Apenas o pH varia. A465 é constante.](https://image.slidesharecdn.com/aula-4-espectrometria-uv-vis-parte-2-170213021708/85/Aula-4-espectrometria-uv-vis-parte-2-19-320.jpg)




