O documento descreve os fundamentos da volumetria de neutralização e o uso de indicadores ácido-básicos para detectar o ponto final de titulações ácido-base. Explica que o pH no ponto de equivalência depende da força dos ácidos e bases envolvidos e que as curvas de titulação teóricas permitem prever a variação do pH durante a titulação e escolher o indicador apropriado.
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
1
UNIVERSIDADE FEDERAL DO PARÁ
INSTITUTO DE CIÊNCIAS EXATAS E NATURAIS
FACULDADE DE QUÍMICA
DISCIPLINA: QUÍMICA ANALÍTICA QUANTITATIVA
TEXTO Nº 3: VOLUMETRIA DE NEUTRALIZAÇÃO
1. INTRODUÇÃO
A volumetria de neutralização compreende titulações de espécies ácidas com
solução padrão alcalina e titulação de espécies básicas com solução padrão ácida.
Comumente, o ponto final da volumetria de neutralização é sinalizado com o
auxílio de indicadores ácidos-básicos. É portanto, muito importante, conhecer o ponto da
escala de pH em que se situa o ponto de equivalência da titulação, visto que cada
indicador possui uma zona de viragem própria, bem como a maneira como varia o pH no
curso da titulação, particularmente em torno do ponto de equivalência.
Casos:
1. Ácido forte + base forte pH no ponto de equivalência = 7
2. Ácido fraco + base forte pH no ponto de equivalência > 7
3. Ácido forte + base fraca pH no ponto de equivalência < 7
A escolha do indicador é sempre feita com base na variação do pH em torno do
ponto de equivalência.
Na análise volumétrica, chama-se de curva de titulação a uma representação
gráfica que mostra a maneira como o logarítmo negativo da concentração do constituinte
ou do reagente (-log[ ]) varia em função do volume do reagente agregado. Este logarítmo
da concentração sofre uma variação notável nas imediações do ponto de equivalência e
este fato é de grande importância para a localização do ponto final e determinação das
fontes de erros de titulação. Na volumetria de neutralização a concentração variável
refere-se ao íon hidrogênio; a curva de titulação é obtida lançando o pH no eixo vertical e
o volume de solução padrão adicionado no eixo horizontal. Esta curva pode ser traçada
com base em medidas experimentais de pH ou mediante considerações teóricas, método
aqui adotado. As curvas de titulação teóricas são de grande importância porque
proporcionam informações quanto a viabilidade e possível exatidão de uma titulação, e
são extremamente úteis na escolha do indicador de ponto final que deverá ser
empregado.](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/75/Texto-n-3-Volumetria-de-Neutralizacao-1-2048.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
2
2. FUNDAMENTOS DO USO DOS INDICADORES ÁCIDO-BÁSICOS
Uma das maneiras usadas para detectar o ponto final de titulações baseia-se no
uso da variação de cor de algumas substâncias chamadas indicadores. No caso
particular das titulações ácido-base, os indicadores são substâncias orgânicas de elevado
peso molecular, que se comportam em solução aquosa como ácidos fracos (indicadores
ácidos) ou bases fracas (indicadores básicos), que por dissociação ou associação sofrem
mudanças estruturais internas que dão lugar a colorações diferentes para a forma não
dissociada e a forma dissociada. Os equilíbrios químicos correspondentes às mudanças
de coloração para os indicadores ácido-básicos podem ser representados por
Indicador ácido: HIn + H2O ⇔ H3O+
+ In-
(1)
Cor A Cor B
ou na forma simplificada, HIn ⇔ H+
+ In-
Indicador básico: In + H2O ⇔ InH+
+ OH-
(2)
Cor B Cor A
Na equação (1), HIn representa a forma ácida (não dissociada) com sua coloração A, e
In-
a forma básica (iônica) com sua coloração B, e na equação (2), In representa a forma
básica (não dissociada) com coloração B, e InH+
a forma ácida (iônica) com sua
coloração A. Para cada indicador, a espécie que predomina com sua respectiva
coloração depende do pH do meio. Em solução fortemente ácida, a espécie molecular
HIn, é a predominante e a solução toma a coloração própria da forma ácida; em solução
básica, predomina a espécie iônica, In
-
, e a solução toma a coloração da forma básica.
A aplicação da “Lei de ação das massas” a equação (1) dá a expressão de
equilíbrio para o indicador ácido-básico,
][
][.][
HIn
InH
KHIn
−+
= (3)
Rearranjando a equação (3) e logaritmando, tem-se:
][
][
][ −
+
=
In
HIn
KH HIn - log [H
+
] = - log KHIn + log
][
][
HIn
In−
pH = pKHIn + log
][
][
HIn
In−
(4)
É comprovado experimentalmente que se:](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-2-320.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
3
a) [HIn] ≥ 10 [In
-
], a cor da espécie HIn é observada
][
][
−
In
HIn
= 10 pH = pKHIn + log
10
1
∴ pH = pKHIn - 1 (5)
b) [In-
] ≥ 10 [HIn], a cor da espécie In-
é observada
][
][
HIn
In−
= 10 pH = pKHIn + log 10 ∴ pH = pKHIn + 1 (6)
de (5) e (6) Intervalo de pH = 1±HInpK (7)
Na realidade, os limites do intervalo de pH de viragem dos indicadores não são
descritos com rigor pela equação (7), pois dependem do indicador e do próprio
observador. A limitação desta expressão deve-se ao fato de que algumas mudanças de
cores são mais fáceis de serem vistas do que outras, e desse modo as aproximações
geralmente feitas na derivação desta expressão nem sempre são aceitas.
De fato, a zona de transição dos indicadores ácido-básicos abrange, geralmente
cerca de duas unidades de pH. Por exemplo, a zona de transição da fenolftaleína (pKa =
9,0) deve estender-se, de acordo com a equação (7), de pH 8 a 10. Semelhantemente,
para o vermelho de fenol (pKa = 7,8), se deveria ter como limites os valores de pH 6,8 e
8,8; entretanto, a faixa é algo mais estreita (pH 6,7 a 8,4) por ser o olho humano menos
sensível as cores envolvidas.
Uma relação similar a da equação (7) é facilmente derivada para um indicador
básico.
O Quadro 3.1 apresenta uma relação selecionada de indicadores ácido-básicos,
com indicações sobre as colorações das formas ácida e básica e respectivas zonas de
transição. Os indicadores ácido-básicos cobrem quase toda a escala de pH, e quase
todos são bicoloridos porque suas formas ácida e básica são ambas coradas; há, porém,
indicadores monocoloridos, como por exemplo, fenolftaleína e timolftaleína.](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-3-320.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
5
3. CURVAS DE TITULAÇÃO DE ÁCIDOS FORTES E BASES FORTES
Quando o reagente titulante e o constituinte são eletrólitos fortes, a reação de
neutralização é descrita pela equação
H+
+ OH-
⇔ H2O KW = [H+
] . [OH-] = 1,0.10-14
(8)
TITULAÇÃO DE ÁCIDO FORTE COM BASE FORTE
Ao ácido contido no frasco de titulação é adicionada a base contida numa bureta.
Antes de iniciada a titulação, a solução contém somente o ácido forte. Iniciada a titulação
e antes do ponto de equivalência, a solução conterá ácido forte mais o sal derivado de
um ácido forte com base forte. No ponto de equivalência, a solução irá conter somente o
sal, enquanto após a ultrapassagem do ponto de equivalência a solução consiste do sal
antes mencionado e do excesso da base forte.
Para ilustrar, construiremos a curva de titulação da neutralização de 50,00 mL de
HCl 0,1 mol/L com NaOH 0,1 mol/L.
A) Cálculo do pH antes da adição da base
Antes de chegar ao ponto de equivalência da titulação existem, em princípio, duas
fontes de íons hidrogênio: o próprio HCl e a ionização da água. Em geral, a concentração
do íon hidrogênio fornecido pelo HCl é o número de milimoles do ácido que ficam sem
titular dividido pelo volume da solução em mililitros. Contudo, quando uma molécula de
água se ioniza se forma um íon hidrogênio e um íon hidróxido. Como a ionização da água
é a única fonte de íons hidróxidos, esta concentração de OH-
é uma medida direta da
concentração de íons H
+
provenientes da ionização da água. Portanto, a concentração
total de íons H+
é a soma das contribuições do HCl e da água, isto é,
[H+
] = [H+
]ácido + [H+
]H 2 O = [H
+
]ácido + [OH
-
]
Antes da adição do titulante NaOH, a concentração do íon hidrogênio com que o HCl
contribui é 0,1 mol/L. A contribuição da água é calculada da seguinte forma:
[[H+
]H 2 O = [OH-
] =
][ +
H
KW 13
14
10001
10
10001 −−−
===
.,]O H[
,
.,
]O H[
_
Como vemos, a concentração de H+
procedente da ionização da água é insignificante.
[H+
] = 0,1 + 1,00.10-13
≅ [H+
] = 0,1 ≅ pH = - log 0,1 ≅ pH = 1,00](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-5-320.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
6
B) Cálculo do pH após adição da base e antes do ponto de equivalência
Exemplo: Adição de 20,00 mL de NaOH 0,1 mol/L
A concentração de íons H
+
é calculada em função do excesso de ácido forte que
fica sem titular
[H+
] =
)
m L
(
V
t i t u l a d on ã oá c i d od osm m o lºn
T O T A L
[H+
] =
)
m L
(
V
a d i c i o n a d oN a O Hsm m o lºni n i c i a lH C lm m o l sºn
T O T A L
−
onde :
nº mmols HCl inicial = Va.Ca
nº mmols NaOH adicionado = Vb.Cb [H+
] = ba
bbaa
VV
C.VC.V
+
−
VTOTAL = Va + Vb
[H+
] =
2050
1,0201,050
+
− xx
=
70
0,3
= [H+
] = 4,3.10-2
pH = 1,37
Dados adicionais que definem a curva na região até próximo do ponto de equivalência
são calculados de modo similar. Os resultados destes cálculos são apresentados na
Tabela 3.1.
C) Cálculo do pH no ponto de equivalência
O ponto de equivalência da titulação é alcançado pela adição de 50,00 mL de
NaOH. Neste ponto, a solução não contém excesso nem de HCl nem de NaOH, com a
água agora sendo a única fonte de íons hidrogênio; então,
[H+
].[OH-
] = 1,00.10-14
[H
+
] = [OH
-
] = W
K
= [H
+
] = 1,00.10
-7
= pH = 7,00
D) Cálculo do pH após o ponto de equivalência
Ultrapassado o ponto de equivalência da titulação, a solução passa a conter
excesso de NaOH e cloreto de sódio. As duas fontes de íons hidroxila são a solução de
NaOH agregada e a ionização da água. A concentração total de íons hidroxila vem dada
por
[OH-
] = [OH-
]NaOH + [OH-
]água](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-6-320.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
7
[OH-
] = T O T A L
V
e x c e s s oe mN a O Hm m o l sºn
+
][ −
OH
KW
Para pontos da curva além do ponto de equivalência, o segundo termo da expressão
acima, devido a ionização da água, é desprezível.
[OH-
] = T O T A L
V
i n i c i a lH C lm m o l sºna d i c i o n a d oN a O Hm m o l sºn
−
[OH-
] = ba
aabb
VV
C.VC.V
+
−
Para adição de 55,00 mL de NaOH 0,1 mol/L, haverá 0,5 mmols de NaOH em excesso
num volume total de solução de 105,00 mL; assim,
[OH-
] =
5055
1,0501,055
+
− xx
= [OH-
] =
105
5,0
= [OH-
] = 4,76.10-3
pOH = 2,32 ⇒ pH = 14,00 - 2,32 = 11,68 pH = 11,68
Dados adicionais para esta titulação, calculados de maneira semelhante, são mostrados
na coluna 2 da Tabela 3.1.
Tabela 3.1. Variação do pH durante a titulação de um ácido forte com uma base forte
Volume de NaOH, mL pH
0,00 1,00
5,00 1,09
10,0 1,18
15,0 1,27
20,00 1,37
25,00 1,48
30,00 1,60
35,00 1,75
40,00 1,95
45,00 2,28
49,90 4,00
49,99 5,00
50,00 7,00
50,05 9,70
55,00 11,68
60,00 11,96](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-7-320.jpg)

![Texto Revisado e Atualizado pela Profª Marta Pinheiro
10
Outra causa de erro é devido ao fato da mudança de cor do indicador ocorrer em
um pH diferente do pH do ponto de equivalência, fazendo com que o volume do titulante
no ponto final seja diferente do volume do titulante no ponto de equivalência da titulação,
isso resulta no chamado erro de titulação, que é um erro determinado e pode ser
calculado pela equação.
Erro de titulação (ET) = 100
x
V
VV
.P E q u i v
.P E q u i vP F i n a l
−
Na prática procura-se escolher um indicador que cause o menor erro de titulação
possível. É necessário frisar que não há necessidade de se eliminar o erro de titulação,
isto é, não é preciso fazer com que o ponto final coincida exatamente com o ponto de
equivalência.
Vejamos, por exemplo, quais dos indicadores listados no Quadro 5.1 seriam
adequados para determinar o ponto final de titulação de 50,00 mL de HCl 0,1 mol/L com
NaOH 0,1 mol/L.
Suponhamos que desejamos efetuar esta titulação de tal modo que o erro da
titulação não seja maior do que ± 0,1%. Por isso, é importante calcular de novo o pH da
solução, 0,1% antes e depois do ponto de equivalência, isto é, para adições de 49,95 a
50,05 mL de NaOH 0,1 mol/L.
Calculemos o pH para a adição destes volumes :
(a) [H+
] =
)
m L
(
V
t i t u l a d on ã oá c i d od om m o lºn
T O T A L
=
95,99
1,005,0 x
[H+
] = 5,00.10-5
mol/L
(b) [OH-
] = T O T A L
V
r e a g i rs e mN a O Hm m o lºn
=
05,100
1,005,0 x
[OH-
] = 5,00.10-5
mol/L
pH = 4,30
pOH = 4,30 ⇒ pH = 9,70](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-10-320.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
11
Com base nestes cálculos, podemos selecionar para esta titulação qualquer dos
indicadores do Quadro 3.1. Que possuem o extremo superior do intervalo de transição
dentro do intervalo de pH de 4,30 a 9,70. Como era de se esperar pela natureza dos
cálculos, a parte vertical da curva de titulação mostrada coincide com este intervalo de
pH. Um total de 14 indicadores citados no Quadro 3.1, começando com o azul de
bromofenol e terminando com o azul de timol garantiriam a exatidão desejada na
titulação.
Vejamos, agora o caso em que o volume no ponto final é calculado
algebricamente, a partir do pH no ponto final da titulação. Considere-se o seguinte
problema:
1) Um volume de 50,0 mL de HCl 0,1 mol/L é titulado com NaOH 0,1 mol/L. Calcular o
erro da titulação admitindo-se pH = 5,0 no ponto final.
Para resolver este problema é necessário calcular o volume de titulante no ponto
final da titulação. Como neste caso o ponto final ocorre antes do ponto de equivalência,
deve-se usar a expressão apropriada para este tipo de cálculo.
[H+
]PF = P Fa
bP Faa
VV
CxVCxV
+
−
Rearranjando-se esta equação para calcular VPF e substituindo-se os demais
dados do problema tem-se que: VPF = 49,99 mL
Erro de Titulação:
ET =
0050
00509949 ,
,,
−
X 100 = - 0,02 %](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-11-320.jpg)

![Texto Revisado e Atualizado pela Profª Marta Pinheiro
13
4. CURVAS DE TITULAÇÃO PARA ÁCIDOS FRACOS COM BASE FORTE
Quatro diferentes tipos distintos de cálculos são necessários para derivar uma
curva de titulação de um ácido fraco com uma base forte:
Como exemplo consideremos a construção da curva de titulação para a
neutralização de 25,00 mL de CH3COOH 0,1 mol/L( Ka = 1,75.10-5
) com NaOH 0,1 mol/L,
que ocorre segundo a reação
CH3COO-
(aq.) + NaOH(aq.) ⇆ CH3COONa(aq.) + H2O(aq.)
A) Cálculo do pH antes da adição da base
A solução contém apenas o ácido fraco, de modo que o pH da solução é calculado
considerando a concentração do soluto e sua constante de dissociação.
CH3COOH ⇒ CH3COO
-
+ H
+
Ka = ]C O O HC H[
]C O OC H[.]H[
3
3
−+
No equilíbrio
[H+
] = [CH3COO-
]
[CH3COOH] = Ca = Cácido
[H
+
] = aa
C.K
= 1,0.10.75,1 5_
= 1,32.10
-3
⇒ pH = 2,88
B) Cálculo do pH após a adição da base e antes do ponto de equivalência
A solução resultante é mistura de CH3COOH que restou sem reagir e de
CH3COONa formado na reação. Desta forma o problema se resume em calcular o pH de
uma solução-tampão, pois se tem uma solução contendo uma mistura de um ácido fraco
e um sal deste ácido.
CH3COOH + NaOH ⇒ CH3COONa + H2O
não titulado sal formado
Ka = ]C O O HC H[
]C O OC H[.]H[
3
3
−+
∴ [H+
] = ]C O OC H[
]C O O HC H[.K
a
−
3
3
= Ka . s a l
á c i d o
C
C](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-13-320.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
14
[H+
] = Ka x f o r m a d os a lm m o lºn
t i t u l a d on ã oá c i d om m o lºn
= Ka x bb
bbaa
C.V
C.VC.V
−
Calculemos o pH para adição de 5,00 mL de NaOH 0,1 mol/L (0,5 mmol de NaOH).
A adição deste volume da base produz um tampão constituído por 2 mmols de CH3COOH
e 0,5 mmols de CH3COONa. Para esta mistura tampão,
[H+
] = 1,75.10-5
x
105
1051025 ,x
,x,x
−
[H+
] = 1,75.10-5
x
50
2, ⇒ 7,00.10-5
⇒ pH = 4,15
Cálculos similares a este fornecem outros pontos da curva, antes do ponto de
equivalência ser alcançado. Resultados destes cálculos são dados na coluna 2 da Tabela
3.2.
C) Cálculo do pH no ponto de equivalência
A solução contém apenas a base conjugada do ácido, isto é, um sal; e o pH será
calculado da concentração deste produto e da constante de hidrólise do sal. Assim
CH3COO-
+ H2O ⇒ CH3COOH + OH-
[OH-
] = s a lb
C.K
= s a l
a
W C.
K
K
= 5
14
10751
05010001
_
_
.,
,..,
= 5,35.10-6
pOH = 5,27 pH = 8,73
Csal =
2525
1,025
+
x
= 0,05
D) Cálculo do pH após o ponto de equivalência
A solução contém sal e mais base em excesso, logo, o pH será calculado em
função da concentração da base forte em excesso.
[OH-
] = T O T A L
V
e x c e s s oe mb a s ed am m o lºn
Exemplo: Adição de 26,00 mL de NaOH 0,1 mol/L
[OH-
] =
2526
10251026
+
−
,x,x
[OH-
] = 1,96. 10-3
⇒ pOH = 2,71 ∴ pH = 11,29](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-14-320.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
15
Cálculos similares a este permitem obter outros pontos da curva, após o ponto de
equivalência ter sido ultrapassado. Resultados destes cálculos são dados na coluna 2 da
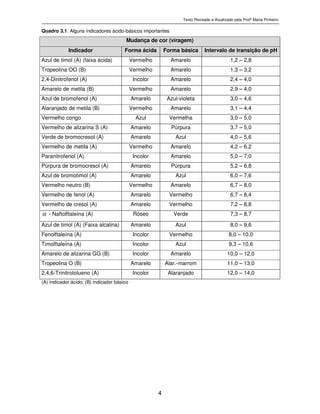
Tabela 3.2, e o gráfico da curva de titulação na Figura 3.2, onde se observa que, na
região ligeiramente além do ponto de equivalência, a curva de titulação de um ácido fraco
com uma base forte é idêntica àquela resultante da titulação de um ácido forte com uma
base forte (Figura 3.1).
ESCOLHA DE INDICADORES
A inspeção visual da curva de titulação mostrada na Figura 3.2 revela que a porção
vertical da curva cobre um intervalo de pH muito menor do que a curva da titulação
análoga da Figura 3.1. É interessante considerar quais dos indicadores listados no
Quadro 3.1 poderiam empregar-se para esta titulação com a certeza de que seu uso não
causaria um erro de titulação superior a ± 0,1%. Por isso, é importante calcular de novo o
pH da solução 0,1% antes e depois do ponto de equivalência, isto é, para adições de
24,975 a 25,025 mL de NaOH 0,1 mol/L.
(a) adição de 24,975 mL de NaOH 0,1 mol/L (2,4975 mmols de NaOH)
[H
+
] = Ka . f o r m a d o sC O O N aC Hd em m o l s
t i t u l a d o sn ã oC O O HC Hd em m o l sºn
3
3
= 1,75.10
-5
.
4975,2
4975,2500,2 −
= 1,75.10
-8
;
pH = 7,76
(b) adição de 25,025 mL de NaOH 0,1 mol/L (2,5025 mmols de NaOH):
[OH-
] = T O T A L
V
e x c e s s oe mb a s ed am m o l s
=
025,50
5000,25025,2 −
= 5,00.10-5
pOH = 4,30 pH = 9,70
Os indicadores selecionados para este tipo de titulação serão aqueles cujo
extremo superior de seu intervalo de viragem estiver dentro do intervalo calculado (7,76 a
9,70). Entre os indicadores listados no Quadro 3.1, os mais apropriados seriam o
vermelho neutro, vermelho de fenol, vermelho de cresol, α - Naftolftaleína e azul de
timol.](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-15-320.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
17
5. CURVAS DE TITULAÇÃO DE BASE FRACA COM ÁCIDO FORTE
Como exemplo, vamos considerar a construção da curva de titulação para a
neutralização de 25,00 mL de solução 0,1 mol/L de NH4OH (Kb = 1,8.10
-5
) com HCl 0,1
mol/L, que ocorre segundo a reação:
NH4OH + HCl ⇒ NH4Cl + H2O
A) Cálculo do pH antes da adição do ácido
O pH será calculado em função da dissociação da base
NH4OH ⇒ NH4
+
+ OH
-
[NH4OH] = Cbase [NH4
+
] = [OH
-
]
Kb = ]O HN H[
]O H[.]N H[
4
4
−+
∴ Kb = ]O HN H[
]O H[
4
2−
∴ [OH-
]2
= Kb . Cbase
[OH-
] = 1,0.10.8,1 5_
= 1,34.10-3
∴ pOH = 2,87 ∴ pH = 11,13
B) Cálculo do pH antes do ponto de equivalência
O pH será calculado em função da solução tampão formada
[OH-
] = f o r m a d os a ld om m o lºn
t i t u l a rs e mb a s ed am m o lºn
.K
b
NH4OH + HCl ⇒ NH4Cl + H2O
não titulado sal formado
Exemplo: Calculemos o pH para adição de 15,00 mL de HCl 0,1 mol/L
[OH-
] = 1,8.10-5
.
1,015
1,0151,025
x
xx −
= 1,8.10-5
x
5,1
1
= 1,20.10-5
;
pOH = 4,92 pH = 9,08
Cálculos análogos a este permitem obterem-se outros pontos da curva antes do
ponto de equivalência](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-17-320.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
18
C) Cálculo do pH no ponto de equivalência
O pH será calculado em função da hidrólise do sal
NH4
+
+ H2O ⇒ NH4OH + H+
[H
+
] = s a la
C.K
∴ [H
+
] = s a l
b
W Cx
K
K
= 5_
14_
10.8,1
05,010.00,1 x
[H+
] = 5,27.10-6
∴ pH = 5,28
Csal = T O T A L
V
a d i c i o n a d oá c i d om m o lºn
∴ Csal =
2525
1,025
+
x
= 0,05
D) Cálculo do pH após o ponto de equivalência
O pH será calculado em função da concentração do ácido forte em excesso
adicionado
[H+
] = T O T A L
V
e x c e s s oe má c i d od osm m o lºn
Exemplo: Adição de 28,00 mL de HCl 0,1 mol/L
[H
+
] =
2825
1,0251,028
+
− xx
=
53
3,0
[H
+
] = 5,66.10
-3
⇒ pH = 2,25
Cálculos similares a este permitem obter outros pontos da curva, além do ponto de
equivalência. O gráfico da curva de titulação é mostrado na Figura 3.3.
ESCOLHA DO INDICADOR
É importante determinar quais indicadores dos contidos no Quadro 5.1 poderiam
ser empregados nesta titulação com a garantia de que seu uso não acarretaria um erro
de titulação maior que ± 0,1%. Para este erro, o intervalo de volume corresponde a
adições de 24,975 a 25,025 mL de HCl 0,1 mol/L.
(a) adição de 24,975 mL de HCl 0,1 mol/L (2,4975 mmols de HCl)
[OH-
] = f o r m a d os a ld om m o lºn
t i t u l a rs e mb a s ed am m o lºn
.K
b
= 1,8.10-5
x
4975,2
0025,0
[OH
-
] = 1,80.10
-6
pOH = 7,74 pH = 6,26](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-18-320.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
19
(b) adição de 25,025 mL de HCl 0,1 mol/L (2,5025 mmols de HCl)
[H+
] = T O T A L
V
e x c e s s oe má c i d od osm m o lºn
=
025,50
0025,0
[H+
] = 5,00.10-5
pH = 4,30
Os cálculos mostram que um indicador ácido-básico adequado para esta titulação
deve possuir o extremo inferior de seu intervalo de transição dentro do intervalo de pH de
6,26 a 4,30. Portanto, dos indicadores listados no Quadro 3.1 os mais adequados são
azul de bromotimol, púrpura de bromocresol e paranitrofenol.
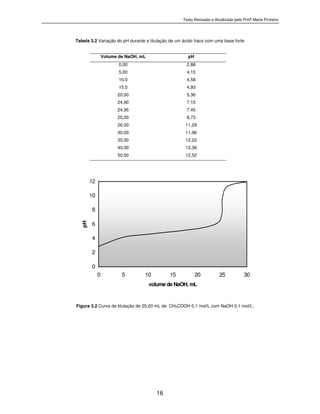
Figura 3.3. Curva de titulação de 25,00 mL de NH4OH 0,1 mol/L com HCl 0,1 mol/L
0
2
4
6
8
10
12
14
0 5 10 15 20 25 30
volume de HCl, mL
pH](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-19-320.jpg)
![Texto Revisado e Atualizado pela Profª Marta Pinheiro
20
LISTA DE EXERCÍCIOS SOBRE VOLUMETRIA DE NEUTRALIZAÇÃO
1) Um indicador ácido tem uma constante de ionização igual a 7,9.10
-6
. A pH = 4,2,
quantas vezes a concentração da forma ácida é maior que a da forma básica.
(R.: [HIn] = 8 [In-
])
2) A constante de dissociação do indicador ácido vermelho de cresol é 6,3.10
-9
. Deixa-se
de observar a presença de uma das formas coradas do indicador quando a
concentração de uma destas é 6 vezes maior que a da outra. Determine a zona de
viragem do indicador. (R.: 7,42 – 9,00)
3) O indicador que é um ácido fraco monoprótico é azul em meio ácido e amarelo em
meio básico. Se a constante do indicador for igual a 1,0.10
-10
. Pergunta-se:
a) Qual é o pH quando 40% do indicador está na forma amarela (R.: pH = 9,82)
4) Considere a titulação de 50,00 mL de HCl 1,00.10-4
mol/L, com uma solução 1,00.10-3
mol/L de NaOH. Calcule o pH da solução após a adição dos seguintes volumes do
titulante: a) 0,00 mL; b) 2,50 mL; c) 4,90 mL; d) 5,00 mL e e) 6,00 mL. (R.: a) pH = 4;
b) 4,32; c) 5,74; d) 7; e) 9,25)
5) Considere a titulação de 20,00 mL de KOH 0,01 mol/L com HNO3 0,01 mol/L. Calcular
o pH da solução após a adição dos seguintes volumes do titulante: a) 0,00 mL; b)
19,99 mL; c) 20,00 mL; d) 25,00 mL. (R.: a) 12; b) 8,40; c) 7; d) 2,95)
6) Considere a titulação de 25,00 mL de HCOOH 0,05 mol/L (Ka = 1,76.10-4
) com KOH
0,1 mol/L. Calcular o pH após adição de 0,00 mL; 12,45 mL; no ponto de equivalência;
13,00 mL. Que indicadores ácido-base o aluno escolheria para esta titulação com um
erro de ± 0,1%, justifique sua resposta. (R.: 2,53; 6,15; 8,14; 11,12; 6,75 – 9,52)
7) Considere a titulação de 25,00 mL de uma solução aquosa de NH4OH (Kb= 1,8.10-5
)
0,25 mol/L com HCl 0,25 mol/L. Calcule o pH da solução após a adição dos seguintes
volumes do titulante: 0,00 mL; 5,00 mL; 15,00 mL; 25,00 mL; 40,00 mL. Qual seria o
erro de titulação em percentagem e com sinal apropriado, se fosse usado como
indicador (1) alaranjado de metila (pH 3,1 – 4,4) e (2) azul de bromotimol (pH 6,0 –
7,6). (R.: ET = + 0,64% ; ET = - 0,068%)
8) Considere o enunciado da questão 6 e responda. Qual seria o erro de titulação com
sinal apropriado, se fosse usado como indicador (1) vermelho de clorofenol (4,8 – 6,4)
e (2) fenolftaleína (8,0 – 10,0). (R.: ET = - 0,24% ; ET = + 0,32%)](https://image.slidesharecdn.com/texton3-neutralizao-130510121446-phpapp01/85/Texto-n-3-Volumetria-de-Neutralizacao-20-320.jpg)