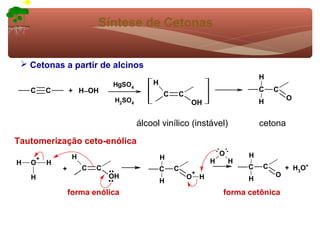
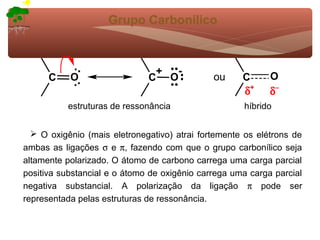
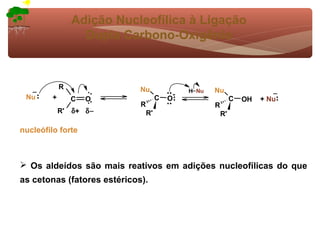
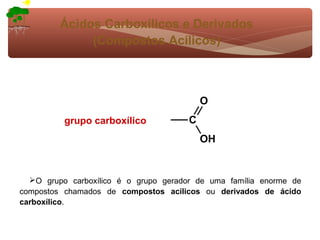
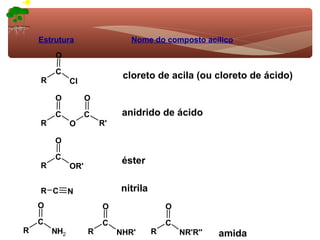
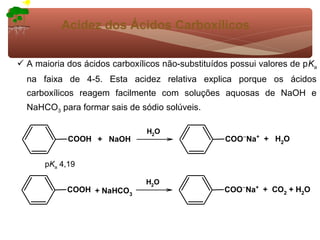
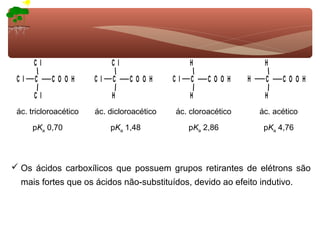
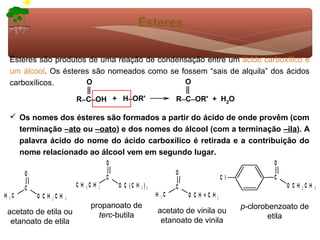
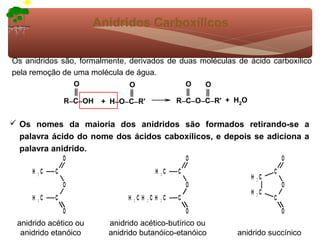
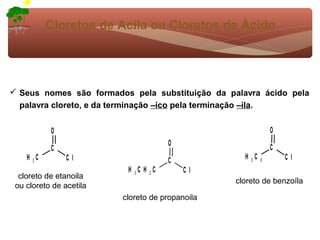
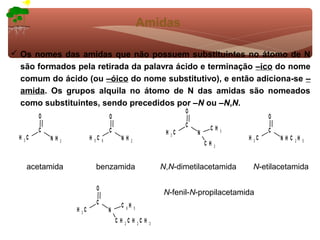
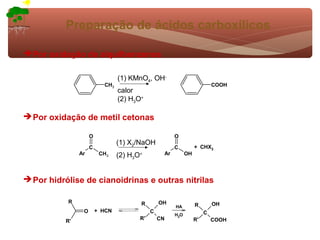
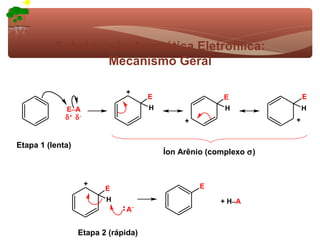
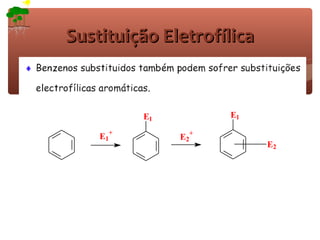
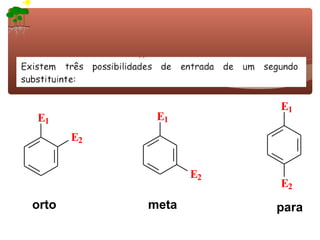
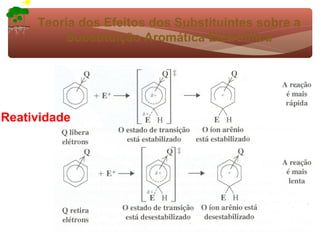
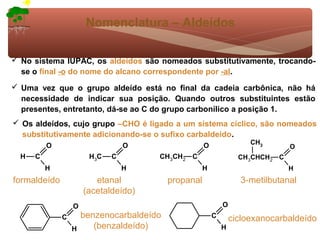
1) O documento discute a substituição aromática eletrofílica, seu mecanismo geral e etapas.
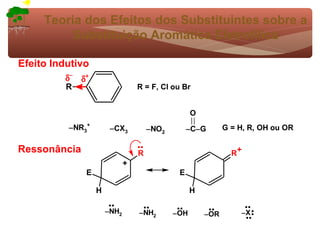
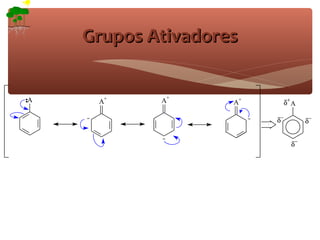
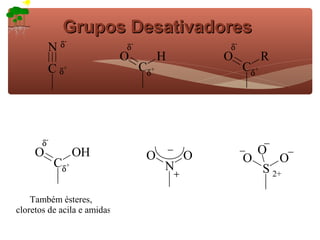
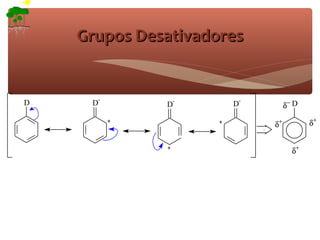
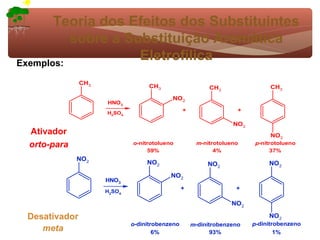
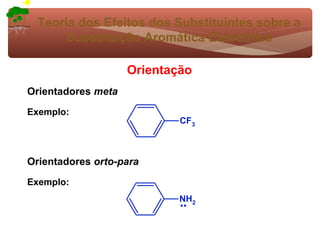
2) São apresentados grupos ativadores e desativadores, que estabilizam ou desestabilizam intermediários catiônicos respectivamente.
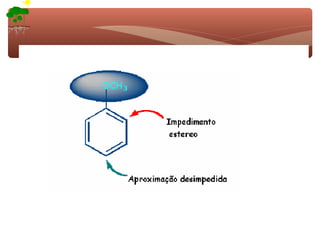
3) A teoria dos efeitos dos substituintes explica como esses grupos afetam a reatividade e orientação da substituição aromática eletrofílica.










![Reações de Oxidação-Redução em
Química Orgânica
A redução de uma molécula orgânica corresponde, normalmente,
ao aumento de seu conteúdo de hidrogênio ou à diminuição de
seu conteúdo de oxigênio.
[H] é o símbolo utilizado para indicar que houve redução sem
especificar o agente redutor.
A oxidação de uma molécula orgânica corresponde,
normalmente, ao aumento de seu conteúdo de oxigênio ou à
diminuição de seu conteúdo de hidrogênio.
[O] é o símbolo utilizado para indicar que houve oxidação sem
especificar o agente oxidante.](https://image.slidesharecdn.com/substituioaromticaeletrofilca-130328185555-phpapp02/85/Substituicao-aromatica-eletrofilica-25-320.jpg)
![Síntese de Aldeídos
O O
[O] [O]
R-CH2OH RCH RCOH
[H] [H]
álcool 1ário aldeído ácido carboxílico
Aldeídos por oxidação de álcoois primários
O
PCC
R-CH2OH RCH PCC = clorocromato de piridínio
CH2Cl2
Aldeídos por redução de ácidos carboxílicos
O O
LiAlH4 LiAlH4
R-CH2OH
RCOH RCH](https://image.slidesharecdn.com/substituioaromticaeletrofilca-130328185555-phpapp02/85/Substituicao-aromatica-eletrofilica-26-320.jpg)