O documento descreve as principais teorias sobre a natureza de ácidos e bases. Resume as definições de ácidos e bases de acordo com Arrhenius, Brønsted-Lowry e Lewis. Explica que segundo Arrhenius, ácidos liberam íons hidrônio e bases liberam íons hidróxido em solução aquosa. Brønsted-Lowry definem ácidos como doadores e bases como receptoras de prótons, enquanto Lewis definem ácidos como aceitadores e bases como doadores de pares de elétrons.







173](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-7-320.jpg)

![Capítulo IV – Ácidos e Bases
em que uma molécula transfere um próton para outra igual, é chamada de autoprotólise
(Fig.4). Como as ligações O—H são fortes, podemos esperar que a fração de prótons
transferida seja muito pequena.
A constante de equilíbrio para a reação A é
a H O + a OH −
K=
(a )
3
2
(1a)
H2O
Em soluções diluídas em água (as únicas que usaremos neste capitulo), o solvente está
quase puro, logo, sua atividade pode ser igual a 1. A expressão resultante é chamada de
constante de autoprotólise da água e é escrita Kw:
K w = a H O + a OH − (1b)*
3
A atividade de um soluto J em uma solução diluída é aproximadamente igual a
molaridade relativa a molaridade padrão, [J]/c°, logo uma forma prática dessa expressão
é
K w = [H 3 O + ] [OH − ]
em que, simplificamos a expressão pela substituição de [J]/c° por [J], o valor numérico da
molaridade.
+ −
Em água pura a 25°C, as concentrações molares de H3O e OH são iguais e têm o
valor experimental 1,0×10-7 mol⋅L–1. Assim,
K w = (1,0 × 10 −7 ) × (1,0 × 10 −7 ) = 1,0 × 10 −14
+ −
As concentrações de H3O e OH são muito pequenas em água pura, o que explica por
que a água pura é tão má condutora de eletricidade. Para imaginar o grau extremamente
baixo da autoprotólise, imagine cada letra deste livro como uma molécula de água.
Precisaríamos procurar em mais de 50 exemplares para encontrar uma molécula de água
ionizada. A reação de autoprotólise é endotérmica (∆H° = +56 kJ⋅mol –1) e, por isso,
r
podemos esperar que Kw aumente de acordo com a temperatura. Todos os cálculos deste
capitulo, entretanto, serão feitos para 25°C.
Chegamos, agora, a um ponto muito importante, que será à base de boa parte
deste e do próximo capitulo. Como Kw é uma constante de equilíbrio, o produto das
+ −
concentrações dos íons H3O e OH é sempre igual a Kw. Podemos aumentar a
+ −
concentração de íons H3O por adição de ácido, porém, a concentração de íons OH
decresce para manter o valor de Kw. Alternativamente, podemos aumentar a concentração
− +
de íons OH por adição de base, mas, então, a concentração de íons H3O diminui. O
+ −
equilíbrio de autoprotólise interliga as concentrações de H3O e OH como uma gangorra;
quando uma sobe, a outra desce (Fig. 4.3)
175](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-9-320.jpg)
![Capítulo IV – Ácidos e Bases
Figura 4.3. O produto das concentrações dos íons hidrônio e hidróxido em água (água
pura e solução em água) é constante. Se a concentração de um tipo de íon cresce, a do
outro deve decrescer, para manter constante o produto das concentrações.
+ −
Nas soluções em água, as concentrações dos íons H3O e OH estão relacionadas pelo
equilíbrio de autoprotólise. Se uma concentração aumenta, a outra diminui para manter o
valor de Kw.
4.1.7. Escala de pH
Até agora, vimos, qualitativamente, que os íons hidrônio estão presentes na água e que,
+
em soluções de ácidos ou bases em água, a concentração de íons H3O depende da
concentração do soluto. Devemos, agora, expressar quantitativamente essa concentração e
ver como ela depende da concentração do acido ou da base na solução. Uma pequena
+
dificuldade é que a molaridade dos íons H3O pode varia em muitas ordens de grandeza:
em algumas soluções pode ser maior do que 1 mol⋅L-1 e, em outras, menor que 10-14
mol⋅L-1. Os químicos evitam a dificuldade de lidar com essa faixa extensa de valores
usando logaritmos. Eles indicam a molaridade do íon hidrônio em termos do pH da
solução, isto é, o logaritmo negativo (na base 10) da atividade do íon hidrônio:
pH = −log a H O + (2a)
3
em que (para soluções suficientemente diluídas pra serem tratadas como ideais)
+
( aH + = [H 3 O + ] / c ° ). Simplificamos a expressão fazendo [H3O ] igual ao valor
3O
+
numérico da molaridade dos íons H3O .
pH = − log [H 3 O + ] (2b)*
176](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-10-320.jpg)
![Capítulo IV – Ácidos e Bases
+
Assim, o pH da água pura, em que a molaridade dos íons H3O é 1,0×10-7 mol⋅L-1, em
25°C, é
pH = − log (1,0 × 10 −7 ) = 7 ,00
Note que o número de dígitos que segue a vírgula do valor numérico de pH é igual ao
número de algarismos significativos da molaridade corresponde, porque os dígitos que
precedem a vírgula correspondem à simplesmente à potência 10 dos dados (como em log
105 = 5). A maior parte das soluções usadas em química tem pH no intervalo de 0 a 14,
mas valores fora dessa faixa são possíveis.
O sinal negativo na definição do pH significa que, quanto maior for a concentração molar
+
de H3O , menor será o pH:
• O pH da água pura é 7.
• O pH de uma solução ácida é menor do que 7.
• O pH de uma solução básica é maior do que 7.
A escala de pH foi introduzida pelo químico dinamarquês Søren Sorensen, em 1909, em
seu trabalho de controle de qualidade da fabricação de cervejas, e é agora usada na
ciência, medicina e engenharia. O valor negativo do logaritmo é usado pra permitir que a
maioria parte dos valores de pH seja números positivos.
Note que quando a concentração do ácido aumenta, o pH diminui. Como o pH é um
logaritmo comum, na base 10, a mudança de uma unidade de pH significativa que a
+
molaridade do íon H3O mudou por um fator igual a 10. Por exemplo, quando a
+
molaridade do íon H3O cresce por um fator de 10, de 10-5 mol⋅L-1 para 10-4 mol⋅L-1, o pH
diminui de 5 para 4.
Podemos estimar rapidamente o pH de uma solução em água usando um papel indicador
universal, que muda de cor em diferentes calores de pH. Medidas mais precisas são feitas
com medidor de pH. Este instrumento é um voltímetro ligado a dois eletrodos que
mergulhem na solução. A diferença de potencial elétrico nos eletrodos é proporcional ao
pH. Logo, quando a escala do medidor está calibrada, o pH pode ser lido diretamente.
Nos Estados Unidos, a Agência de Proteção Ambiental (EPA) define o rejeito como
“corrosivo” se o pH for menor que 3,0 (muito ácido) ou maior do que 12,5 (muito básico).
O suco de limão, cujo pH é cerca de 2,5, seria considerado corrosivo. O mesmo aconteceria
em soluções com soluções 1 м de NaOH(aq), em que é 14.
+
Para converter o pH em molaridade de H3O , inverteremos o sinal e tomamos seu
antilogaritmo:
[H O ] = 10
3
+ − pH
mol ⋅ L−1 (3)
+ +
A escala de pH é usada par indicar a molaridade dos íons H3O : pH = - log [H3O ]. Um
pH alto indica que a solução é básica, e um pH baixo indica que ela é ácida. Uma solução
neutra tem pH = 7.
177](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-11-320.jpg)
![Capítulo IV – Ácidos e Bases
4.1.8 pOH de Soluções
Muitas expressões quantitativas que envolvem ácidos e bases são extremamente
simplificadas e mais facilmente lembradas quando usamos logaritmos. A quantidade pX é
uma generalização de pH:
pX = −log X (4)
Pó exemplo, pOH é definido como
pOH = − log a OH − (5a)
que, pela mesma razão do pH, é simplificada como
pOH = − log [OH − ] (5b)*
−
O pOH é conveniente para expressar as molaridades dos íons OH em solução. Por
−
exemplo, na água pura, em que a molaridade dos íons OH é 1,0×10-7 mol⋅L-1, o pOH é
7,00. Do mesmo modo, entendemos por pKw, que
pK w = − log K w = − log (1,0 × 10 −14 ) = 14 ,00
Os valores de pH e pOH estão relacionados. Para encontrar a relação, começamos com a
+ −
expressão da constante de autoprotólise da água, Kw = [H3O ][OH ]. Então, tomamos de
ambos os lados e usamos log ab = log a + log b. Obtemos
log [H 3 O + ] + log [OH − ] = log K w
Multiplicando os dois lados da equação por (– 1), temos
[ ] [ ]
− log H 3 O + − log OH − = −log K w
que é mesmo que
pH + pOH = pK w (6a)
Como pKw = 14,00, em 25°C, nesta temperatura
pH + pOH = 14 ,00 (6b)*
A Equação 6 mostra que o pH e o pOH de uma solução têm valores complementares: se
um aumenta, o outro diminui, para que a soma permaneça constante (Figura 4.4).
178](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-12-320.jpg)

![Capítulo IV – Ácidos e Bases
Todas essas espécies estão em um equilíbrio dinâmico incessante. Do mesmo modo, no
caso de uma solução de base fraca, imaginamos
• as moléculas ou íons básicos,
−
• pequenas concentrações de íons OH e do ácido conjugado da base, formados por
transferência de prótons das moléculas da água, e
+
• uma concentração extremamente pequena de íons H3O , que mantém o equilíbrio
de autoprotólise.
Como os ácidos e bases conjugados estão em equilíbrio em solução, podemos expressar a
força de um ácido ou de uma base em termos da constante de equilíbrio da transferência
de prótons entre o soluto e o solvente. Por exemplo, para o ácido acético em água,
+ −
CH3COOH(aq) + H2O(l) H3O (aq) + CH3CO2(aq) (B)
A constante de equilíbrio é
a H O + a CH CO −
K= 3 3 2
a CH 3 COOH a H 2 O
Como as soluções que estamos examinando são diluídas e a água é quase pura, a
atividade de H2O pode ser como sendo igual a 1. A expressão resultante é chamada de
constante de acidez, Ka. Se fizermos a aproximação de substituir as atividades das
espécies de soluto pelos valores numéricos das molaridades, podemos expressar a
constante de acidez do ácido acético como
Ka =
[H O ] [CH CO ]
3
+
3
−
2
(7)
[CH 3 COOH]
O valor experimental de Ka, para o ácido acético, em 25°C, é 1,8×10-5. Esse valor pequeno
indica que só uma pequena na parte das moléculas de CH3COOH doa seus prótons
quando dissolve em água. Dependendo da concentração, cerca de 99 em 100 moléculas de
CH3COOH permanecem intactas. Esse valor é típico dos ácidos fracos em água (Fig.
10.13). Em geral, a constante de acidez de um ácido HA é
HA(aq) + H2O(l)
+
H3O (aq) +
−
A(aq) Ka =
[H O ] [A ]
3
+ −
(8)*
[HA ]
A tabela 4.1 lista as constantes de acidez de alguns outros ácidos fracos.
180](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-14-320.jpg)
![Capítulo IV – Ácidos e Bases
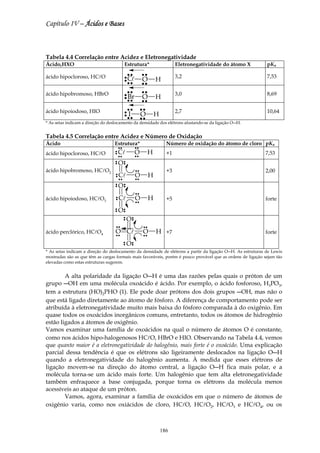
Tabela 4.1 Constantes de acidez em 25°C*
Ácido Ka pKa Ácido Ka pKa
ácido tricloro-acético, CCl3COOH 3,0×10-1 0,52 ácido fórmico, HCOOH 1,8×10-4 3,75
ácido benzenossulfônico, C6H5SO 3H 2,0×10-1 0,70 ácido benzóico, C6H5COOH 3,0×10-5 4,19
ácido iódico, HIO3 1,7×10-1 0,77 ácido acético, CH3COOH 3,0×10-5 4,75
ácido sulfuroso, H2SO3 1,5×10-2 1,81 ácido carbônico, H2CO3 3,0×10-7 6,37
ácido cloroso, HClO2 1,0×10-2 2,00 ácido hipocloroso, HClO 3,0×10-8 7,53
ácido fosfórico, H3PO4 7,6×10-3 2,12 ácido hipobromoso, HBrO 3,0×10-9 8,69
ácido cloro-acético, CH2ClCOOH 1,4×10-3 2,85 ácido bórico, B(OH)3 3,0×10-10 9,14
ácido láctico, CH3CH(OH)COOH 8,4×10-4 3,08 ácido cianídrico, HCN 3,0×10-10 9,31
ácido nitroso, HNO2 4,3×10-4 3,37 fenol, C6H5OH 3,0×10-10 9,89
ácido fluorídrico, HF 3,5×10-4 3,45 ácido hipoiodoso, HIO 3,0×10-11 10,64
* Os valores de Ka listados foram calculados a partir de valores de pKa com mais algarismos significativos do que os
mostrados, de forma a minimizar os erros de arredondamento. Os valores dos ácidos polipróticos – aqueles capazes de doar
mais de um próton – referem-se à primeira desprotonação.
+ -
O equilíbrio de transferência de prótons é B(OH)3(aq) + H2O(l) H3O(aq) + B(OH)4(aq) .
Podemos também escreve uma constante de equilíbrio para o equilíbrio de transferência
de prótons de uma base em água. No caso da amônia em água, por exemplo,
+ −
NH3 (aq) + H2O(l) NH4(aq) + OH(aq) (C)
a constante de equilíbrio é
a NH + a OH −
K= 4
a H 2 O a NH 3
Em soluções diluídas, a água é quase pura e sua atividade pode ser considerada como
sendo igual a 1. Com essa aproximação, obtemos a constante de basicidade, Kb. Se
fizermos a aproximação de substituir as atividades das espécies do soluto pelos valores
numéricos das molaridades, podemos expressar a constante de basicidade da amônia
como
Kb =
[NH ] [OH ]
+
4
−
[NH 3 ]
Para a amônia em água, em 25°C, o valor experimental de Kb é 1,8×10-5. Este valor
pequeno indica que só uma pequena fração das moléculas de NH3 está presente como
+
NH4 . Cálculos de equilíbrio mostram que somente 1 em cada 100 moléculas está
protonada em uma solução (Fig. 10.14). Em geral, a constante de basicidade de uma base
B em água é
B(aq) + H2O(l)
+
HB (aq) +
−
OH(aq) K a =
[HB ] [OH ]
+ −
(9)*
[B]
181](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-15-320.jpg)

![Capítulo IV – Ácidos e Bases
amônia, a reação C, para qual a constante de basicidade já foi dada (Kb =
+ −
[NH4 ][OH ]/[NH3]). Vejamos, agora, o equilíbrio de transferência de prótons do ácido
+
conjugado da amônia, NH4 , em água:
+
NH4(aq) + OH(aq)
−
H2O(l) + NH3 (aq) Kb =
[NH ] [OH ]
+
4
−
[NH 3 ]
A multiplicação das duas constantes de equilíbrio dá
Ka × Kb =
[H O ] [NH ] = [NH ] [OH ] = [H O ] [OH ]
3
+
3
+
4
−
+ −
[NH ] +
4 [NH ] 3
3
Do lado direito, reconhecemos Kw e podemos escrever
Ka × Kb = Kw (11a)*
Nessa expressão, Ka é a constante de acidez de um ácido fraco e Kb é a constante de
basicidade da base conjugada desse ácido, um par ácido-base conjugada (como
− +
CH3COOH/CH3CO2 ou NH4 /NH3). Podemos expressar a Eq. 11a de outra maneira,
tomando os logaritmo de ambos os lados da equação:
log K a + log K b = log K w
A multiplicação de todos os termos da equação por –1 dá
pK a + pK b = pK w (11b)*
A Equação 11, em qualquer de suas formas, confirma a relação de “gangorra” entre as
forças dos ácidos e se suas bases conjugadas. Se um ácido tem Ka alto, a base conjugada
deve ter Kb baixo. Do mesmo modo, se uma base tem Kb alto, então seu ácido conjugado
tem Ka baixo. Essa relação recíproca está resumida na Tabela 4.3. Por exemplo, como o pKa
+
da amônia em água é 4,75, o pKa de NH4 é
pK a = pK w − pK b = 14 ,00 − 4 ,75 = 9 ,25
Tabela 4.3 Pares Ácido-Base Conjugados na Ordem da Força
Nome do ácido Fórmula do ácido Fórmula da base Nome da base
Ácido forte Base muito fraca
−
ácido iódico HI I íon iodeto
−
ácido perclórico HClO4 HClO4 íon perclorato
−
ácido bromídrico HBr Br íon cloreto
−
ácido sulfúrico H2SO4 HSO4 íon hidrogenossulfato
183](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-17-320.jpg)



![Capítulo IV – Ácidos e Bases
uma base fraca. Veremos, também, como calcular o pH de uma solução em que um cátion
ou o ânion de um sal são também um ácido ou base fracos.
4.3.1. Soluções de Ácidos Fracos
Nossa primeira tarefa é calcular o pH de uma solução de um ácido fraco, como o
ácido acético em água. A concentração inicial do ácido é a concentração em que ele foi
preparado, como se as moléculas ácidas não tivessem doado prótons. No caso de =um
+
ácido forte , a concentração de H3O em solução é igual à concentração inicial do ácido
forte, porque todas as moléculas do ácido estão desprotonadas. Entretanto, para encontrar
+
a molaridade de H3O na soluções de ácidos fracos, temos que levar em conta o equilíbrio
-
entre ácido HA e sua base conjugada A (Eq. 8). Espera-se que o pH esteja entre 7, um
valor que indica nenhuma desprotonação, e o valor que obteríamos para um ácido forte,
totalmente desprotonado. A técnica, baseada no uso de tabelas de equilíbrio é
desenvolvida na Caixa de Ferramentas 4.1.
O cálculo resumido na Caixa de Ferramenta 4.1 também permite predizer a percentagem
de desprotonação, isto é, a percentagem de moléculas de HA que estão desprotonadas em
+
solução. Para calcular a porcentagem de desprotonação, usaremos a igualdade [H3O ] =
− − +
[A ], que vem da relação estequiométrica 1 mol A 1 mol H3O para reação de
desprotonação da Eq. 8:
Percentagem de
=
molaridade de A −
× 100% =
[H 3 O + ] × 100% (12)*
desprotonação molaridade inicial de HA [HA ]inicial
CAIXA DE FERRAMENTAS 4.1
COMO CALCULAR O pH DE UMA SOLUÇÃO DE UM ÁCIDO FRACO
BASE CONCEITUAL
Como o equilíbrio de transferência de prótons se estabelece assim que o ácido fraco se dissolve na
água, as concentrações do ácido, do íon hidrônio e da base conjugada devem sempre satisfazer a
constante de acidez do ácido. Pode-se calcular essas quantidades construindo uma tabela de
equilíbrio.
PROCEDIMENTO
Etapa 1 Escrever a equação química e Ka do equilíbrio de transferência de prótons. Construa uma
+ -
tabela com as colunas denominadas ácido, HA, H3O e base conjugada do ácido, A . Na primeira
linha, coloque as molaridades iniciais das espécies.
Nesta etapa, imagine que não houve desprotonação das moléculas do ácido.
Etapa 2 Escreva, na segunda linha , as mudanças de molaridade necessárias para que a reação
atinja o equilíbrio.
Como o número de moléculas de ácido desprotonado é desconhecido, imagine que a molaridade
do ácido diminui de x mol⋅L-1 como resultado da desprotonação. A reação estequiométrica dá as
188](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-22-320.jpg)
![Capítulo IV – Ácidos e Bases
demais mudanças em termos de x.
Etapa 3 Escreva, na terceira linha, as molaridades de equilíbrio, adicionando a mudança de
molaridade (etapa 2) aos valores iniciais de cada substância (etapa 1)
+ −
Ácido, HA H3O Base conjugada, A
Etapa 1 Molaridade inicial [HA]inicial 0 0
Etapa 2 Mudança de molaridade –x +x +x
Etapa 3 Molaridade de equilíbrio [HA]inicial – x x x
Embora uma mudança de concentração possa ser positiva (acréscimo) ou negativa (decréscimo), o
valor da concentração deve ser sempre positivo.
Etapa 4 Use o valor de Ka para calcular o valor de x.
O cálculo de x pode ser feito freqüentemente simplificado, desprezando-se as mudanças inferiores
a 5% da molaridade inicial do ácido. Entretanto, no final do cálculo, é preciso verificar se x é
consistente com a aproximação, calculando a percentagem de ácido desprotonado. Se essa
percentagem for inferior a 5%, então a expressão exata para Ka deverá ser resolvida para x. o
cálculo envolve, com freqüência, a resolução de equações de segundo grau. Embora posamos
calcular o pH com o número de algarismos apropriados aos dados iniciais, as respostas são, em
geral, consideravelmente menos confiáveis do que isso. Uma das razões é que estamos ignorando
as interações entre os íons em solução, quando usamos concentrações em vez de atividades.
Este procedimento está ilustrado nos exemplos 4.1 e 4.1
Uma pequena percentagem de moléculas desprotonadas indica que o soluto contém
+
principalmente o ácido HA. A concentração de íons H3O e dos íons da base conjugada
deve, então, ser muito pequena.
A autoprótolise da água contribui significativamente par o pH, quando o ácido está tão
+
diluído ou tão fraco que o cálculo indica molaridades de H3O próximas de 10-7 mol⋅L-1.
Nestes casos, deve-s usar o procedimento descrito nas seções 3.5.1 e 3.5.2. Só se pode
+
ignorara a contribuição da autoprótolise da água quando a molaridade calculada de H3O
é substancialmente (cerca de 10 vezes) maior do que 10-7 mol⋅L-1, que corresponde a um
pH 6 ou menor.
EXEMPLO 4.1 Calcular o pH e a percentagem de desprotonação de um ácido fraco
Calcule o pH e a percentagem de desprotonação de 0,10 м CH3COOH(aq) sabendo que a
constante Ka do ácido acético é 1,8 × 10-5.
SOLUÇÃO Siga o procedimento da Caixa de Ferramenta 10.1 e escreva o equilíbrio de
transferência de prótons,
+ −
CH3COOH(aq) + H2O(l) H3O (aq) + CH3CO2(aq)
189](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-23-320.jpg)
![Capítulo IV – Ácidos e Bases
Ka =
[H O ] [CH CO ]
3
+
3
−
2
[CH 3 COOH]
e a tabela de equilíbrio, com as molaridades em mols por litro:
Espécies
+ −
CH3COOH H 3O CH3CO2
Etapa 1 Molaridade inicial 0,10 0 0
Etapa 2 Mudança de molaridade –x +x +x
Etapa 3 Molaridade de equilíbrio 0,10 – x x x
Etapa 4 Substitua as molaridades de equilíbrio na expressão da constante de acidez:
x×x
K a = 1,8 × 10 − 5 =
0 ,10 − x
Imagine que x << 0,10 e escreva uma aproximação
−5 x2
1,8 × 10 ≈
0 ,10
Resolva para x.
x≈ (0 ,10 ) × (1,8 × 10 − 5 ) = 1,3 × 10 − 3
+ +
Calcule o pH a partir de pH = – log [H3O ]; [H3O ] = x.
pH ≈ −log (1,3 × 10 −3 ) = 2 ,89
Da Eq. 12, com [HA]inicial = 0,10
1,3 × 10 −3
Percentagem de desprotonação = × 100% = 1,3%
0 ,10
Vê-se que x é menor que 5% de 0,10 e a aproximação é válida.
Como o pH< 6, a hipótese de que a autoprotólise da água pode ser ignorada é válida.
EXEMPLO 4.2 Cálculo da constante Ka de um ácido fraco a partir do pH
O pH de uma solução 0,010 м do anti-séptico ácido mandélico, em água, é 2,95. Qual é a
constante de acidez Ka do ácido mandélico?
ESTRATÉGIA: Podemos calcular a concentração do íon hidrônio a partir do pH e, então
calcular o valor de Ka a partir da concentração inicial do ácido e da concentração do íon
hidrônio.
SOLUÇÃO
Etapa 1: A partir de
[H O ] = 10
3
+ − pH
, [H O ] = 10
3
+ −2 , 95
mol ⋅ L−1 = 0 ,0011 mol ⋅ L−1
190](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-24-320.jpg)
![Capítulo IV – Ácidos e Bases
Etapa 2: Anote as relações entre as concentrações de equilíbrio
[H O ] = [A ]
3
+ −
e [HA] = [HA ]inicial − [H 3 O + ]
Etapa 3: Escreva a expressão de Ka:
=
[H O ] [A ] =
3
+ −
[H O ]3
+ 2
⇒ Ka =
(0 ,0011)2
= 1,4 × 10 − 4
− [H O ]
Ka
[HA ] [HA ] inicial 3
+
0 ,010 − 0 ,0011
Para calcular o pH e a percentagem de desprotonação de uma solução de ácido fraco,
+
construa uma tabela de equilíbrio e determine a molaridade de H3O usando a constante de
acidez.
4.3.2. Soluções de Bases Fracas
No tratamento dos ácidos fracos, estávamos interessados na percentagem de
desprotonação. Da mesma forma, quando descrevemos as forças de bases fracas é
importante conhecer a percentagem de protonação, isto é, a percentagem de moléculas de
base que foram protonadas:
Percentagem
=
molaridade de HB +
× 100% =
[HB ] × 100%
+
(13)*
de protonação molaridade inicial de B [B]inicial
Aqui, [B]inicial é a concentração molar inicial da base, isto é, sua molaridade, imaginando-se
que não ocorreu protonação.
CAIXA DE FERRAMENTA 4.2
COMO CALCULAR O pH DE UMA SOLUÇÃO DE BASE FRACA
BASE CONCEITUAL
Como o equilíbrio de transferência de prótons se estabelece assim que a base fraca se dissolve na
água, logo, pode-se calcular a concentração do íon hidróxido a partir da concentração inicial da
base e do valor da constante de basicidade. Como os íons hidróxido estão em equilíbrio com os
íons hidrônio, pode-se usar pOH e pKw para calcular o pH.
PROCEDIMENTO
Etapa 1 Escreva o equilíbrio de transferência de próton e construa uma tabela com as colunas
+ −
intituladas base B, ácido conjugado BH e OH . Na primeira linha, coloque as molaridades iniciais
de cada espécie.
Para os valores inicias, imagine que não houve protonação das moléculas da base.
Etapa 2 Escreva as mudanças de molaridade necessárias para que a reação atinja o equilíbrio.
Imagine que a molaridade da base diminui de x mol⋅L-1 como conseqüência da protonação. Use a
estequiométrica da reação para escrever as demais mudanças em termos de x.
191](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-25-320.jpg)
![Capítulo IV – Ácidos e Bases
Etapa 3 Escreva as molaridades de equilíbrio, adicionando a mudança de molaridade (etapa 2) aos
valores iniciais de cada substância (etapa 1)
+ −
Base, B Ácido conjugado BH OH
Etapa 1 Molaridade inicial [B]inicial 0 0
Etapa 2 Mudança de molaridade –x +x +x
Etapa 3 Molaridade de equilíbrio [B]inicial – x x x
Embora uma mudança de concentração possa ser positiva (acréscimo) ou negativa (decréscimo), o
valor da concentração deve ser sempre positivo.
Etapa 4 Use o valor de Kb para calcular o valor de x.
O cálculo de x pode ser freqüentemente simplificado, como vimos na Caixa de Ferramentas 3.1.
−
Ignore as contribuições da autoprotólise da água para a concentração de íons OH se essa for
superior a 10-6 mol⋅L-1.
Etapa 5 Determine pOH da solução e calcule o pH a partir a partir do pOH usando a Eq. 6b.
Este procedimento está ilustrado nos exemplos 10.9.
Como na Caixa de Ferramentas 10.1, embora nós calculemos o pH até o número de casas decimais
apropriadas para os dados, as respostas são freqüentemente menos confiáveis dos que o obtido.
Calculamos o pH das soluções de bases fracas de mesma forma que calculamos o pH das
soluções de ácidos fracos – usando a técnica de equilíbrio. O equilíbrio de protonação é
dado pela Eq. 9. para calcular o pH da solução, primeiro é preciso determinar a
−
molaridade dos íons OH no equilíbrio, expressar essa molaridade como pOH, e, então,
calcular o pH a partir da relação pH + pOH = 14 em 25°C. para bases muito diluídas ou
muito fracas, a autoprotólise de água tem de ser levada em conta.
EXEMPLO 4.3 Cálculo do pH e da porcentagem de protonação de uma base fraca
Calcule o pH e a porcentagem de protonação de uma solução 0,20 м de metilamina,
CH3NH2, em água. a constante Kb de CH3NH2 é 3,6 × 10-4.
SOLUÇÃO Siga o procedimento de Caixa de Ferramenta 4.2 e escreva o equilíbrio de
transferência de prótons:
+ + −
H2O(l) + CH3NH2(aq) CH3NH3 (aq) + OH(aq)
Kb =
[CH NH ] [OH ]
3
+
3
−
[CH 3 NH 2 ]
A tabela de equilíbrio, com todas as concentrações em mols por litro, é
192](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-26-320.jpg)
![Capítulo IV – Ácidos e Bases
Espécies
+ −
CH3NH2 CH3NH3 OH
Etapa 1 Molaridade inicial 0,20 0 0
Etapa 2 Mudança de molaridade –x +x +x
Etapa 3 Molaridade de equilíbrio 0,20 – x x x
Etapa 4 Substitua as molaridades de equilíbrio na expressão da constante de basicidade.
x×x
K b = 3 ,6 × 10 − 4 =
0 ,20 − x
Imagine que x << 0,20 e escreva uma aproximação
x2
3 ,6 × 10 − 4 ≈
0 ,20
Resolva para x.
x≈ (0 ,20 ) × (3,6 × 10 − 4 ) = 8,5 × 10 − 3
Verifique se x << 0,20.
8,5 × 10-3 << 0,20; logo, a aproximação é válida.
− −
Encontre o pOH a partir de pOH = – log [OH ]; [OH ] = x.
pOH ≈ − log (8 ,5 × 10 −3 ) = 2 ,10
Etapa 5 A partir de pH = pKw – pOH.
pH ≈ 14 ,00 − 2 ,10 = 11,90
+
Temos da Eq. 13, com [HB ] = x e [B]inicial = 0,20
8 ,5 × 10 −3
Percentagem de protonação = × 100% = 4 ,2%
0 ,20
+
Isto é, 4,2% de metilamina está presente na forma protonada, CH3NH3 .
Como o pH é maior que 8, a hipótese de o equilíbrio domina o pH e a autoprotólise da
água pode ser ignorada é válida.
Para calcular o pH de uma solução de base fraca, construa a tabela de equilíbrio e calcule o
pOH, a partir do valor de Kb. Converta pOH em pH usando a relação pH + pOH = 14,00.
193](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-27-320.jpg)


![Capítulo IV – Ácidos e Bases
EXEMPLO 4.4 Cálculo o pH de uma solução de um sal com um cátion ácido
Estime o pH de uma solução 0,15 м NH4Cl(aq).
+ −
ESTRATÉGIA: Como NH4 é ácido e Cl é neutro, espera-se pH<7. Trata a solução como a
de um ácido fraco e use a tabela de equilíbrio descrita no procedimento da Caixa de
Ferramentas 4.1 para calcular a composição e o pH. Primeiro, escreva a equação química
de transferência de próton para a água e a expressão de Ka. Se o valor de Ka não estiver
disponível, obtenha-o a partir do Kb da base conjugada, usando Ka = Kw/Kb (Eq. 11a). A
molaridade inicial do cátion ácido é igual à molaridade do cátion que o sal produziria se
estivesse completamente dissociado e o cátion retivesse todos os seus prótons. As
+
molaridades iniciais de sua base conjugada e de H3O são tidas como zero.
SOLUÇÃO O equilíbrio relevante é
+ +
NH3(aq) K a =
[H O ] [NH ]
3
+
3
[NH ]
NH4 (aq) + H2O(l) H3O(aq) + +
4
Na Tabela 4.2, encontramos Kb = 1,8 × 10-5 para NH3. Use a seguinte tabela de equilíbrio,
com todas as concentrações em mols por litro:
Espécies
+ +
NH4 H 3O NH3
Etapa 1 Molaridade inicial 0,15 0 0
Etapa 2 Mudança de molaridade –x +x +x
Etapa 3 Molaridade de equilíbrio 0,15 – x x x
Etapa 4 De Ka = Kw/Kb,
1,0 × 10 −14
Ka = −5
= 5 ,6 × 10 − 10
1,8 × 10
Substitua as molaridades de equilíbrio na expressão da constante de acidez.
x×x
5 ,6 × 10 − 5 =
0 ,15 − x
Suponha que x << 0,15 e simplifique a expressão
x2
5 ,6 × 10 − 5 ≈
0 ,15
Resolva para x.
x≈ (0 ,15 ) × (5,6 × 10 − 5 ) = 9 ,2 × 10 − 6
+ +
Calcule o pH a partir de pH = – log [H3O ]; [H3O ] = x.
196](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-30-320.jpg)
![Capítulo IV – Ácidos e Bases
pH ≈ − log (9 ,2 × 10 −6 ) = 5 ,04.
A aproximação de que x é menor do que 5% de 0,15 é válida. Além disso, a molaridade de
+
H3O (9,2 × 10-6 mol⋅L-1) é muito maior do que a gerada pela autoprotólise da água (1,0 ×
10-7 mol⋅L-1) e, por isso, desprezar sua contribuição é válido.
EXEMPLO 4.5 Cálculo do pH de uma solução de um sal com um ânion básico
Estime o pH de 0,15 м Ca(CH3CO2)2(aq).
ESTRATÉGIA O equilíbrio de transferência de prótons é
− − [CH 3 COOH] [OH − ]
OH(aq) K b =
[CH CO ]
H2O(l) + CH3CO2 (aq) CH3COOH(aq) + −
3 2
−
O íon CH3CO2 é a base conjugada de um ácido fraco, logo, a solução será básica e espera-
se pH>7. Use o procedimento da Caixa de Ferramentas 3.2, obtendo a concentração inicial
da base a partir da concentração do sal adicionado. É preciso obter a constante Kb do
ânion básico, que teremos de calcular a partir da constante Ka do ácido conjugado. A
tabela de equilíbrio leva a um valor de pOH que deve ser convertido em pH usando pH +
pOH = 14,00.
−
SOLUÇÃO A molaridade inicial de CH3CO2 é 2 × 0,15 mol⋅L-1 = 0,30 mol⋅L-1, porque cada
−
fórmula unitária do sal fornece dois íons CH3CO2 . A Tabela 3.1 dá a constante Ka de
CH3COOH como sendo 1,8 × 10-5.
Espécies
− −
CH3CO2 CH3COOH OH
Etapa 1 Molaridade inicial 0,30 0 0
Etapa 2 Mudança de molaridade –x +x +x
Etapa 3 Molaridade de equilíbrio 0,30 – x x x
−
Etapa 4 Encontre Kb do íon CH3CO2 a partir de Kb = Kw/Ka,
1,0 × 10 −14
Ka = = 5 ,6 × 10 − 10
1,8 × 10 − 5
Substitua as molaridades de equilíbrio na expressão Ka.
x×x
5 ,6 × 10 − 5 =
0 ,30 − x
Imagine que x é menor do que 5% de 0,30 (isto é < 0,15).
197](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-31-320.jpg)
![Capítulo IV – Ácidos e Bases
x2
5 ,6 × 10 − 5 ≈
0 ,30
Resolva para x.
x≈ (0 ,30 ) × (5,6 × 10 − 5 ) = 1,3 × 10 − 5
Verifique a hipótese x < 0,015.
1,3 × 10-3 << 0,015
− −
Encontre o pOH a partir de pOH = – log [OH ]; [OH ] = x.
pOH ≈ − log (1,3 × 10 −5 ) = 4 ,89
Calcule o pH a partir de pH = pKw – pOH.
pH ≈ 14 ,00 − 4 ,89 = 9 ,11
−
A molaridade de OH produzida no equilíbrio de transferência de prótons (1,3 × 10-5
mol⋅L-1) é muito maior do que da autoprotólise da água (1,0 × 10-7 mol⋅L-1); assim,
desprezar a autoprotólise é válido.
Os sais que contêm ácidos conjugados de bases fracas produzem soluções ácidas em água. O
mesmo fazem os sais que contêm cátions de metal pequenos e com carga elevada. Os sais
que contêm bases conjugadas de ácidos fracos produzem soluções básicas em água.
4.4. Ácidos e Bases Polipróticos
Um ácido poliprótico é um composto que pode doar mais de um próton. Muitos
ácidos comuns são polipróticos, entre eles o sulfúrico, H2SO4, é o ácido carbônico, H2CO3,
que pode doar dois prótons, e o ácido fosfórico, H3PO4, que pode doar três prótons. Os
ácidos polipróticos têm papel importante em sistemas biológicos, porque muitas enzimas
podem ser consideradas como ácidos polipróticos que desempenham suas funções vitais
doando um próton após o outro. Uma base poliprótica é uma espécie que pode aceitar
2- 2-
mais de um próton. Exemplos incluem os ânions CO3 e SO3 , que podem aceitar dois
3-
prótons, e o ânion PO4 , que pode aceitar três ânions.
A principal diferença entre ácidos polipróticos e monopróticos é que os primeiros doam
os prótons em etapas sucessivas de desprotonação. Por exemplo, o ácido carbônico pode
−
perder um próton para formar HCO3 , que, por sua vez, pode doar o próton remanescente
2-
para formar CO3 . Precisamos saber quando e como levar em conta as desprotonações
sucessivas ao estimar o pH de uma solução de ácido poliprótico ou de um de seus sais.
3-
Além disso, veremos como as concentrações relativas de íons em solução, como PO4 ,
2- −
HPO4 , H2PO4 , dependem do pH da solução.
198](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-32-320.jpg)

![Capítulo IV – Ácidos e Bases
+
Isso faz com que a molaridade de H3O seja igual à molaridade original do ácido, 0,010
−
mol⋅L-1. Esse valor corresponde a pH = 2,0. Entretanto, a base conjugada, HSO4 , também
contribui com prótons para a solução e o segundo equilíbrio de transferência de prótons
tem de ser levado em consideração:
− + 2-
HSO4 (aq) + H2O(l) H3O(aq) + SO4 (aq) Ka2 = 0,012
Portanto, para calcular o pH de uma solução de ácido sulfúrico, é preciso montar uma
tabela de equilíbrio, em que as concentrações iniciais são as da primeira desprotonação
− + 2-
[HSO4 ] = 0,010 mol⋅L-1, [H3O ] = 0,010 mol⋅L-1, [SO4 ] = 0 mol⋅L-1, e, então, resolver a
equação para obter o novo valor da concentração do íon hidrônio:
=
[H O ] [SO ] ;
3
+ 2−
4
0 ,012 =
(0 ,010 + x ) (x )
[HSO ]
K a2 −
4 0 ,010 − x
+
que leva a x = 4,5 × 10-3, [H3O ] = 0,014 mol⋅L-1 e pH = 1,9.
Os demais ácidos polipróticos, diferentemente do ácido sulfúrico, são ácidos fracos e as
suas constantes de acidez sucessivas de desprotonação são, normalmente, muito
diferentes. Como resultado disso, podemos tratar os ácidos polipróticos, à exceção do
ácido sulfúrico, ou os sais de qualquer ânion deles derivados, como sendo a única espécie
de concentração significativa em solução. Essa aproximação leva a uma grande
simplificação: para calcular o pH de ácidos polipróticos, basta usar Ka1 e só levar em conta
a primeira desprotonação. Em outras palavras, tratar o ácido como se fosse um ácido
monoprótico fraco. As desprotonações subseqüentes ocorrem, mas não afetam
significativamente o pH e podem ser ignoradas.
Estime o pH de um ácido poliprótico para o qual todas as desprotonações são fracas usando
somente o primeiro equilíbrio de desprotonação, e considere insignificantes as
desprotonações posteriores. Uma exceção é o ácido sulfúrico, o único ácido poliprótico
comum que é u ácido forte em sua primeira desprotonação.
4.4.2. Soluções de Sais de Ácidos Polipróticos
A base conjugada de um ácido poliprótico é anfiprótica, isto é, pode agir como um ácido
ou como uma base. Ela pode doar seu átomo de hidrogênio ácido ou aceitar um átomo de
−
hidrogênio e voltar ao ácido original. Por exemplo, um íon hidrogenossulfeto, HS , em
água, age como um ácido ou como uma base:
− + 2-
HS(aq) + H2O(l) H3O(aq) + S (aq) Ka2 = 7,1 × 10-15
pKa2 = 14,15
− −
HS(aq) + H2O(l) H2S(aq) + OH(aq) Kb1 = Kw/Ka1 = 7,7 × 10-8
Na segunda linha, Kb1 foi obtido usando-se a relação KaKb = Kw e a constante do H2S, o
−
ácido conjugado de HS :
200](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-34-320.jpg)


![Capítulo IV – Ácidos e Bases
x2
K a 1 = 7 ,6 × 10 − 3 =
0 ,10 − x
Imagine que x << 0,10 e decida se é válido aproximar a expressão.
−3 x2
7 ,6 × 10 ≈
0 ,10
x ≈ 0,028
Como valor de x não é muito menor do que 0,10, use a equação do segundo grau.
(7 ,6 × 10 )× (0,10 − x ) = x
−3 2
Rearranje a equação.
x 2 + (7 ,6 × 10 −3 )x − 7 ,6 × 10 −4 = 0
Resolva para x.
x = 2 , 4 × 10 −2 ou x = −3 ,2 × 10 −2
Rejeite a raiz negativa.
x = 2 ,4 × 10 −2
Da tabela de equilíbrio, encontramos:
[H 3 O + ] = [H 2 PO 2 ] = 2 , 4 × 10 −2 mol ⋅ L−1
−
[H 3 PO 4 ] ≈ 0 ,10 − 2 ,4 × 10 −2 mol ⋅ L−1 = 0 ,08 mol ⋅ L−1
2-
Etapa 2 Use, agora, Ka2 = 6,2 × 10-8 para encontrar a concentração de HPO4 . Como Ka2 <<
+
Ka1, podemos seguramente imaginar que a concentração de H3O calculada na etapa 1 não
muda na segunda desprotonação. O equilíbrio de transferência de prótons é
− + 2-
H2PO4 (aq) + H2O(l) H3O(aq) + HPO4 (aq)
Construa a tabela de equilíbrio com as concentrações em mols por litro, usando os
+ −
resultados da etapa 1 para as concentrações de H3O e H2PO4 .
Espécies
− + 2-
H2PO4 H 3O HPO4
Etapa 1 Molaridade inicial 2,4 × 10-2 2,4 × 10-2 0
Etapa 2 Mudança de molaridade –x +x +x
Etapa 3 Molaridade de equilíbrio 2,4 × 10-2 – x 2,4 × 10-2 + x x
203](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-37-320.jpg)
![Capítulo IV – Ácidos e Bases
Substitua as molaridades de equilíbrio em Ka2.
K a 2 = 6 ,2 × 10 − 8 =
(2,4 × 10 + x )× x
-2
2,4 × 10 − x -2
Como Ka2 é muito pequeno, considere x << 2,4 × 10-2.
6 ,2 × 10 − 8 ≈
(2,4 × 10 + x )× x
-2
=x
2,4 × 10 - 2
Verifique se x << 2,4 × 10-2.
6 ,2 × 10 −8 << 2,4 × 10 -2
2-
Resolva para [HPO4 ]
[HPO ] = x ≈ K
2−
4 a2 = 6 ,2 × 10 −8 mol ⋅ L−1
Pode-se concluir que a segunda desprotonação é pouco importante.
2- 3-
Etapa 3 A perda do último próton de HPO4 produz o íon fosfato, PO4 :
2- + 3-
HPO4 (aq) + H2O(l) H3O(aq) + PO4 (aq)
A constante de equilíbrio Ka3 = 2,1 × 10-13, um valor muito pequeno. Podemos imaginar
+ −
que a concentração de H3O calculada na etapa 1 e a concentração de H2PO4 calculada na
etapa 2 não são afetadas pela desprotonação adicional. Podemos, então, construir a tabela
de equilíbrio em mols por litro:
Espécies
2- + 3-
HPO4 H 3O PO4
Etapa 1 Molaridade inicial (da etapa 2) 6,2 × 10-8 2,4 × 10-2 0
Etapa 2 Mudança de molaridade –x +x +x
Etapa 3 Molaridade de equilíbrio 6,2 × 10-8 – x 2,4 × 10-2 + x x
Substitua as molaridades de equilíbrio em Ka3:
K a 3 = 2 ,1 × 10 − 13 =
(2,4 × 10 + x )× x
-2
6,2 × 10 − x -8
Como Ka3 é muito pequeno, podemos imaginar que x << 6,2 × 10-8 e simplificar a equação.
2 ,1 × 10 − 13
=
(2,4 × 10 ) × x -2
6,2 × 10 - 8
Resolva para x.
x=
(2 ,1 × 10 ) (6,2 × 10 ) = 5,4 × 10
−13 -8
- 19
2,4 × 10 -2
204](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-38-320.jpg)
![Capítulo IV – Ácidos e Bases
3-
Resolva para [PO4 ]
[PO ] = x ≈ 5,4 × 10
3−
4
−19
mol ⋅ L−1
2-
O íon HPO4 se desprotona muito pouco, o que justifica a hipótese de que a concentração
+
de H3O não é afetada pela terceira desprotonação.
− +
Etapa 4 Encontre a concentração de OH a partir de Kw e da concentração de H3O :
−14
[OH ] = [HKO ] = 1,,0 × 10
− w
+
2 4 × 10 −2
mol ⋅ L− 1 = 4 ,2 × 10 − 13 mol ⋅ L− 1
3
Faça um resumo das concentrações de todos os solutos em uma solução 0,10 м H3PO4(aq)
colocando-as em ordem decrescente de concentração:
Espécie Concentração (mol⋅L-1)
H3PO4 0,08
HO
+ 2,4 × 10-2
3
H2PO4
− 2,4 × 10-2
HPO4
2- 6,2 × 10-8
OH
− 4,2 × 10-13
PO4
3- 5,4 × 10-19
As concentrações de todas as espécies de uma solução de um ácido poliprótico podem ser
calculadas imaginando-se que as espécies presentes em pequenas quantidades não afetam as
concentrações das espécies presentes em grandes quantidades.
4.4.4. Composição e pH
Às vezes é necessário saber como as concentrações dos íons de um ácido
poliprótico variam de acordo com o pH. Essa informação é particularmente importante no
estudo das águas naturais, como as de rios e lagos. Por exemplo, se estivéssemos
examinando o ácido carbônico na água da chuva, poderemos esperar que, em pH baixo, a
espécie totalmente protonada (H2CO3) predomine. Já, em pH alto, podemos esperar que a
2-
espécie completamente desprotonada (CO3 ) predomine e que em pH intermediário, a
−
espécie intermediaria (HCO3 , neste caso) predomine. Podemos verificar
quantitativamente essas expectativas.
205](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-39-320.jpg)
![Capítulo IV – Ácidos e Bases
COMO FAZEMOS ISSO?
Para mostrar como as concentrações das espécies presentes em uma solução variam de
acordo com o pH, usaremos, como exemplo, o sistema do ácido carbônico. Considere os
seguintes equilíbrios de transferências de prótons:
H2CO3(aq) + H2O(l)
+
H3O(aq) + HCO3 (aq)
−
K a1 =
[H O ] [HCO ]
3
+ −
3
[H 2 CO 3 ]
− + 2-
K a2 =
[H O ] [CO ]
3
+ 2−
3
[HCO ]
HCO3 (aq) + H2O(l) H3O(aq) + CO3 (aq) −
3
Podemos expressar a composição da solução em termos da fração, α(X), de carbonato
− 2-
presente na forma de cada espécie X, em que X pode ser H2CO3, HCO3 , CO3 e
α( X ) =
[X ]
[H 2 CO 3 ] + [HCO − ] + [CO 2 − ]
3 3
−
É útil expressar α(X) em termos da razão entre cada espécie intermediária HCO3 . Poe isso,
−
dividimos o numerador e o denominador por [HCO3 ] para obter
[X ] [HCO 3 ]
−
α( X ) =
([H 2 CO 3 ] [HCO 3 ] + 1 + [CO 2 − ] [HCO − ])
−
3 3
As três razões de concentrações podem ser escritas em termos do íon hidrônio.
Rearranjando as expressões das constantes de acidez:
[H 2 CO 3 ] = [H 3 O + ] [CO 2 − ] = K a2
= 3
=
[HCO ] −
3 K a1 [HCO ] [ −
3 H3O + ]
Portanto, as três frações são
α(H 2 CO 3 )=
[H O ] 3
+ 2
; α (HCO 3 ) =
− [H O ]K
3
+
a1
; α (CO 2 − ) =
K a1 K a 2
(15a)
3
f f f
em que
f = [H 3 O + ] + [H 3 O + ]K a 1 + K a 1 K a 2
2
(15b)
Essas equações permitem predizer a composição em qualquer pH.
Vejamos se as três expressões da Eq. 15a confirmam nossas expectativas. Em pH elevado,
a concentração de íons hidrônio é muito baixa e, portanto, os numeradores em α(H2CO3) e
206](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-40-320.jpg)
![Capítulo IV – Ácidos e Bases
−
α(HCO3 ) são muito pequenos, como esperado. Quando o pH é baixo, a concentração de
íons hidrônio é alta e, portanto, o numerador em α(H2CO3) é grande e esta espécie
predomina.
Se substituirmos por valores numéricos, poderemos ver como os α variam de acordo com
− −
o pH. O valor α(HCO3 ) ≈ 1 em pH intermediário. O valor máxima de α(HCO3 ) ocorre em
pH = 1
2 (pK a1 + pK a 2 )
Observe que a forma totalmente protonada torna-se predominante quando pH<pKa1 e a
forma totalmente protonada, quando pH>pKa2. Cálculos semelhantes podem ser feitos
para sais de ácidos tripróticos em água.
A fração de espécies desprotonadas aumenta quando o pH aumenta.
4.5 Autoprotólise e pH
Suponha que tivéssemos de estimar o pH de 1,0 × 10-8 м HCl(aq). Se usássemos as
técnicas do Exemplo 10.3 para calcular o pH a partir da concentração do ácido inicial,
encontraríamos um pH igual a 8. Este valor, entretanto, é absurdo, porque ele está além
da neutralidade, do lado básico, pois HCl é um ácido! O erro origina-se no fato de que
existem duas fontes de íons hidrônio, mas só consideramos uma. Em concentrações muito
baixas de ácido, o fornecimento de íons hidrônio pela autoprotólise da água é comparável
ao proveniente da concentração muito baixo de HCl e ambos devem ser levados em
conta. As duas próximas seções mostram como incluir a autoprotólise, primeiro para os
ácidos e bases fortes e, depois, para os fracos.
4.5.1. Soluções Muito Diluídas de Ácidos e Bases Fortes
Só temos de incluir a contribuição da autoprotólise par o pH quando a
concentração de ácido ou base forte for inferior a 10-6 mol⋅L-1. Para calcular o pH, nesses
casos, é preciso incluir todas as espécies em solução. Como exemplo, examinemos uma
+ − −
solução de HCl, um ácido forte. Além da água, as espécies presentes são H3O , OH e Cl .
Existem três concentrações desconhecidas. Para encontra-las, precisamos de três equações.
Uma equação leva em consideração o balanço de cargas, isto é, a necessidade de que a
solução seja eletricamente neutra. Em outras palavras, as concentrações de cátions e
+
ânions devem ser iguais. Como só existe um tipo de cátion, H3O , a concentrações de íons
+ − −
H3O deve ser igual à soma das concentrações dos ânions Cl e OH . A relação do balanço
+ − −
de cargas [H3O ] = [Cl ] + [OH ] indica que
[OH ] = [H O ] − [Cl ]
−
3
+ −
A segunda leva em conta o balanço material, o fato de que todo o soluto adicionado deve
ser explicado, ainda que ele esteja presente na forma de íons. Neste exemplo, o balanço
−
material mostra que a concentração de íons Cl é igual à concentração do HCl adicionado
207](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-41-320.jpg)
![Capítulo IV – Ácidos e Bases
inicialmente (todas as moléculas de HCl estão desprotonadas). Se anotarmos o valor
−
numérico desta concentração inicial como [HCl]inicial, a relação do balanço material é [Cl ]
= [HCl]inicial. Podemos combinar essa relação com a equação anterior e escrever
[OH ] = [H O ] − [HCl]
−
3
+
inicial
A terceira equação é a constante de autoprotóise, Kw (Eq. 1). Substituindo a expressão
−
precedente para [OH ] nessa equação:
K w = [H 3 O + ] [OH − ] = [H 3 O + ]([H 3 O + ] − [HCl]inicial )
e rearranjando essa expressão em uma equação de segundo grau:
[H O ]
3
+ 2
− [HCl]inicial [H 3 O + ] − K w = 0 (16)
Como vimos no Exemplo 4.4, é possível usar a fórmula da solução da equação de segundo
grau para resolve-la e obter a concentração de íons hidrônio.
Vejamos, agora, uma solução muito diluída de uma base forte, como o NaOH. Além da
+ − +
água, as espécies são Na , OH e H3O . Como fizemos para o HCl, podemos escrever as
três equações que relacionam as concentrações desses íons, usando o balanço de cargas, o
balanço material e a constante de autoprotólise. Como os cátions presentes são os íons
hidrônio e os íons sódio, a relação de balanço de carga é
[OH ] = [H O ] + [Na ]
−
3
+ +
A concentração de íons sódio é a igual à concentração inicial de NaOH, [NaOH]inicial. Tem-
se, portanto, que
[OH ] = [H O ] + [NaOH]
−
3
+
inicial
A constante de autoprotólise é
K w = [H 3 O + ]([H 3 O + ] + [NaOH]inicial ) (17)
A concentração de íons hidrônio pode ser obtida resolvendo-se esta equação do segundo
grau.
EXEMPLO 4.8 Estimativa do pH de uma solução muito diluída de ácido forte
Qual é o pH de 8,0 × 10-8 м HCl(aq)?
+
SOLUÇÃO Faça [HCl]inicial = 8,0 × 10-8 mol⋅L-1 e x = [H3O ] e substitua os valores na
equação 16.
208](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-42-320.jpg)
![Capítulo IV – Ácidos e Bases
[
A partir de H 3 O + ] 2
− [HCl]inicial [H 3 O + ] − K w = 0
x=
(8,0 × 10 ) ± (8,0 × 10 )
−8 −8 2
− 4(1)(− 1,0 × 10 − 14 )
2
−7
= 1,5 × 10 ou − 6 ,8 × 10 −8
+
A raiz negativa deve ser rejeitada. Ficamos com [H3O ] = 1,5 × 10-7 mol⋅L-1, logo pH = 6,82.
Em soluções muito diluídas de ácidos e bases fortes, o pH é significativamente afetado pela
autoprotólise da água. O pH é determinado pela resolução de três equações simultâneas: a
expressão de Kw, a equação do balanço de cargas, e a equação do balanço material.
4.5.2. Soluções Muito Diluídas de ácidos Fracos
A autorpotólise também contribui para o pH de soluções muito diluídas de ácidos
fracos. Alguns ácidos, tais como o ácido hipoiodoso, HIO, são tão fracos e sofrem tão
pouca desprotonação que a autoprotólise da água quase sempre contribui
significativamente para o pH. Para encontrar o pH dessas soluções, temos de levar em
conta a autoprotólise da água.
COMO FAZEMOS ISSO?
O cálculo do pH de soluções muito diluídos de um ácido fraco, HA, é semelhante ao dos
ácidos fortes descrito na seção 10.18. Ele se baseia no fato de que, além da água, existem
− + −
quatro espécies em solução, ou seja, HA, A , H3O e OH . Como existem quatro
desconhecidos, precisamos de quatro equações para encontrar suas concentrações. Duas
relações que podem ser usadas são a constante de autoprotólise da água e a constante de
acidez do ácido HA:
[
K w = H3O +
] [OH ] −
e Ka =
[H O ] [A ]
3
+ −
[HA ]
O balanço de cargas fornece uma terceira equação:
[H O ] = [OH ] + [A ]
3
+ − −
O balanço material dá a quarta equação: a concentração total de grupos A (por exemplo,
átomos de F, se o ácido adicionado for HF) deve ser igual à concentração inicial do ácido:
[HA ]inicial = [HA ] + [A − ]
Para encontrar uma expressão para a concentração de íons hidrônio em termos da
concentração inicial do ácido, usamos a relação do balanço de cargas para expressar a
− +
concentração de A em termos de [H3O ]:
209](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-43-320.jpg)
![Capítulo IV – Ácidos e Bases
[A ] = [H O ] − [OH ]
−
3
+ −
−
Então, expressamos [OH ] em termos da concentração de íons hidrônio usando a equação
da autoprotólise:
[A ] = [H O ] − [HKO ]
−
3
+ w
+
3
Ao substituir essa expressão na equação do balanço material, temos
Kw
[HA ]inicial = [HA] + [A − ] = [HA ]inicial − [H 3 O + ] −
[H 3 O + ]
= [HA ]inicial − [H 3 O + ] +
Kw
[H 3 O + ]
−
Agora, substituímos as expressões de [HA] e [A ] em Ka para obter:
[H O ] [H O ] − HKO
+
+ w
Ka =
3
[3
]
3
+
(18)
− [H O ] +
K
[HA ] + w
inicial
[H O ]
3
3
+
A Eq. 18 intimida um pouco, mas ela pode ser freqüentemente simplificada quando se
leva em conta as condições experimentais empregadas. Por exemplo, em muitas soluções
+
de ácidos fracos, a concentração de íons hidrônio é tão alta que [H3O ] > 10-6 (isto é, pH <
+
6). Nessas condições, Kw/[H3O ] < 10-8, e esse termo pode ser ignorado no numerador e no
denominador da Eq. 18. A expressão de Ka simplificada é igual à equação familiar que
usamos quando a autoprotólise da água tem efeito insignificante sobre o pH (Seção 10.11):
=
[H O ] 3
+ 2
− [H O ]
Ka (19)
[HA] inicial 3
+
+
Quando o ácido é tão diluído ou tão fraco que [H3O ] > 10-6 não é verdadeiro (isto é,
quando o pH fica entre 6 e 7), temos que usar a expressão completa, a Eq. 18. Para saber o
+
que isso envolve, escrevemos x = [H3O ] e rearranjamos a Eq. 18
x 3 + K a x 2 − (K w + K a [HA ]inicial )x − K a K w = 0 (20)
Essa é uma equação cúbica em x. Para resolvê-la, o melhor é usar uma calculadora gráfica
ou um software matemático.
210](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-44-320.jpg)
![Capítulo IV – Ácidos e Bases
EXEMPLO4.8 Estimativa do pH de uma solução diluída de um ácido fraco em água
Use a Eq. 20 para estimar o pH de uma solução 1,0 × 10-4 м de fenol em água.
SOLUÇÃO Usando a Tabela 10.1, vemos que para o fenol, Ka vale 1,3 × 10-10. Como
K w + K a [HA ]inicial = 1,0 × 10 −14 + (1,3 × 10 −10 ) × (1,0 × 10 −4 ) = 2 ,3 × 10 −14 ,
K a K w = (1,3 × 10 − 10 ) × (1,0 × 10 − 14 ) = 1,3 × 10 − 24 .
A Equação 20 torna-se
x 3 + (1,3 × 10 −10 )x 2 − (2 ,3 × 10 −14 )x − 1,3 × 10 −24 = 0
Para simplificar os coeficientes, podemos escrever x = y × 10-7 e dividir a equação
resultante por 10-21. Ela se torna, então,
y 3 + 0 ,0013 y 2 − 2 ,3 y − 0 ,0013 = 0
A Figura 10.20 mostra o gráfico dessa função. A única raiz positiva é y = 1,516; logo, x =
1,516 × 10-7 e
pH = −log (1,516 × 10 −7 ) = 6 ,8
Em soluções de ácidos muito fracos em água, a autoprotólise da água deve ser levada em
conta se a concentração de íons hidrônio for menor do que 10-6 mol⋅L-1. As expressões de Ka
e Kw são combinadas com as equações do balanço de cargas e do balanço material para o
cálculo do pH.
211](https://image.slidesharecdn.com/cidosebases-121010212049-phpapp01/85/aCidos-e-bases-45-320.jpg)