Comida congelada, suco de caixinha, pipoca de micro-ondas, sopa instantânea, nuggets, enlatados.
Produtos alimentícios como esses, ícones da vida moderna e que enchem nossos carrinhos de supermercados, não fazem jus ao caminho percorrido por nossos antepassados ao longo da história para manter a barriga cheia, o corpo nutrido e a saúde em dia.
No início era a coleta. Há cerca de 200 mil anos, nossos ancestrais, que eram nômades, se alimentavam de frutos e raízes, consumiam carne de caça, peixe e possivelmente moluscos in natura. Como num drive-thru paleolítico, eles aproveitavam as ofertas alimentícias que encontravam pelo caminho. Ainda nesta época, nossos parentes hominídeos inventaram de assar e cozinhar os alimentos. E foram levando a vida assim, durante alguns milhares de anos. Eles andavam, caçavam, pescavam e comiam. Se não se mexessem, ou se a oferta era escassa, passavam fome.
Muito tempo depois, há aproximadamente 10 mil anos, veio a mudança que influenciaria a alimentação, a cultura e as sociedades humanas até hoje: a agricultura. Cansados de vagar, e com a experiência de milênios acumulada, nossos ancestrais resolveram fixar residência. Passaram a viver às margens de rios e lagos, cultivando trigo, cevada, milho, arroz e cereais – estes que são a base da alimentação tradicional de diferentes povos por todo o planeta até hoje. Ao mesmo tempo, dava-se início a criação de bovinos, ovinos, caprinos e suínos. Também começaram a produzir bebidas e alimentos líquidos usando cereais, caules, grãos, vagens, brotos; além de cozidos, ensopados e condimentos.
Na antiguidade, comida também era remédio – Nos tempos antigos, o que chegava à mesa, pelo menos das elites, já era bastante variado. As tumbas do Antigo Egito (a partir do quarto milênio a.C) mostram os alimentos consumidos pelos faraós: massas, carnes, peixes, laticínios, frutas, legumes, cereais, condimentos, especiarias e mel. Os egípcios eram também grandes conhecedores dos segredos da farmacopeia e das propriedades das ervas medicinais.
Na Antiguidade Clássica – o longo período em que se destacaram as civilizações grega e romana – também eram conhecidos os efeitos preventivos e terapêuticos da alimentação. Os escritos de Hipócrates, grego conhecido como pai da medicina, mostravam alguns produtos alimentícios consumidos na Grécia Antiga e já faziam uma associação entre alimentos e o combate a doenças.
Admirável Mundo Novo – Outra grande virada nesta história ocorreu por volta de 500 anos atrás, com as Grandes Navegações (séculos XV e XVI). Começava ali a primeira onda de globalização, quando os europeus saíram desbravando mares, conquistando novas terras e povos e, obviamente, diversificando o prato deles de cada dia. O que seria do molho das massas italianas, se não fosse o tomate, fruto nativo da América Central, que começou a ser cultivado pela Civilização Inca? Isso sem falar nas asiáticas laranja, banana e manga, que cruzaram mares e vieram fazer sucesso nas lavouras e mesas da Am


![A auto- ionização da água pura produz
concentração muito baixa de iões H3O+
e OH-
H2O + H2O H3O+
(aq) + OH-
(aq)
K =
[H3O+
] [OH-
]
[H2O] 2
K [H2O] 2
= [H3O+
] [OH-
]
Kw = [H3O+
] [OH-
]
constante de
ionização da água
[H2O] = 55,5
mol/L constante
(25 ºC)
Reação de auto-ionização da água](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-3-320.jpg)
![H2O + H2O H3O+
(aq) + OH-
(aq)
[H3O+
] = [OH-
] = 1,0 x 10-7
mol/L 25 ºC
Kw = 1,0 x 10-14
25 ºC
constante de ionização da
água
Reação de auto-ionização da água
Kw = [H3O+
] [OH-
]
= (1,0 x 10-7
) (1,0 x 10-7
)
= 1,0 x 10-14](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-4-320.jpg)
![Para soluções aquosas, 25 ºC:
Solução neutra: [H3O+
] = [OH-
]
[H3O+
] = [OH-
] = 1,0 x 10-7
mol/L
Solução ácida: [H3O+
] > [OH-
]
[H3O+
] > 1,0 x 10-7
mol/L e
[OH-
] < 1,0 x 10-7
mol/L
Solução básica: [H3O+
] < [OH-
]
[H3O+
] < 1,0 x 10-7
mol/L e
[OH-
] > 1,0 x 10-7
mol/L
Equilíbrio Ácido-Base](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-5-320.jpg)
![Ácidos e Bases: Uma breve revisão
Arrhenius: ácidos aumentam a [H+
] e
bases aumentam a [OH-
] em uma
solução aquosa.
Arrhenius: ácido + base sal + água.
Problema: a definição se aplica a
soluções aquosas.
Ácidos = substâncias
que produzem iões
H3O+
(H+
), quando
dissolvidos em água
Bases = substâncias
que produzem iões
OH-, ao serem
dissolvidos em água](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-6-320.jpg)





![Ácidos e Bases
Ácido Base
Lewis
Produzem íons
H3O+
(H+
)
= dissolvidos em
H2O
Produzem íons
OH-
= dissolvidos
em H2O
Bronsted
- Lowry
H+
(aq) + :OH-
(aq) H2O
Doa
pares de
elétrons
Aceita
pares de
elétrons
Arrhenius
Aceita um
próton [H+
]
=[H3O+
]
H2O + H2O H3O+
(aq) + OH-
(aq)
a1
a2
b2
b1
Doa próton
[H+
] =[H3O+
]](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-12-320.jpg)
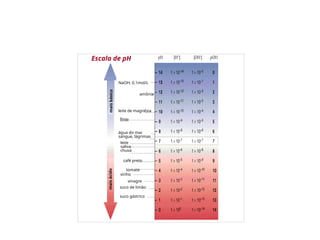
![Concentração de íons H+
= expressa em
termos do negativo do logaritmo decimal
de sua concentração(mol/L) = pH
pH = - log[H+
]
Água neutra: [H3O+
] = [OH-
]
[H3O+
] = [OH-
] = 1,0 x 10-7
mol/L
pH = - log(1,0 x 10-7
) = 7
Escala de pH](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-13-320.jpg)
![Escala de pH
pH = - log[H+
] = - log[H3O+
] e
pOH = - log[OH-
]
Na água neutra a 25 C:
[H+
] = [OH-
] = 1,0 x 10-7
pH = pOH = 7,0 (meio neutro)
Em soluções ácidas:
[H+
] > 1.0 10-7
; pH < 7,0.
Em soluções básicas:
[H+
] < 1.0 10-7
; pH > 7,0.
Quanto > o pH, mais básica é a solução.](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-14-320.jpg)


![Ácidos fracos estão apenas
parcialmente ionizados em solução.
Há uma mistura de íons e ácido não
ionizado na solução.
Equilíbrio de ácidos fracos:
HA(aq) + H2O(l) H3O+
(aq) + A-
(aq)
[HA]
]
][A
O
[H -
3
a
K
[HA]
]
][A
[H -
a
K
Ka = constante de dissociação do ácido
ou
Ácidos fracos](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-18-320.jpg)

![Usando Ka para calcular o pH
Escreva a equação química balanceada
do equilíbrio.
Escreva a expressão de Ka e as
concentrações inicial e no equilíbrio (x =
mudança na concentração de H+
).
pH = - log [H+
] = - log [1,4x 10-3
]
pH = 2,9
Ácidos fracos](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-20-320.jpg)
![% de ionização = força do ácido
100
]
HA
[
]
[H
ionização
%
0
.
equ
= 1,4 %
Ácidos fracos](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-21-320.jpg)


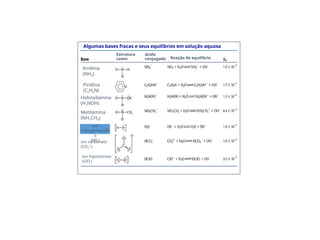
![Bases fracas removem prótons das
substâncias.
Há um equilíbrio entre a base e os íons
resultantes:
Exemplo:
A constante de dissociação da base (Kb):
NH3(aq) + H2O(l) NH4
+
(aq) + OH-
(aq)
]
NH
[
]
OH
][
NH
[
3
-
4
b
K
Bases fracas
Weak base + H2O conjugate acid + OH-
Base fraca Ácido conjugado](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-24-320.jpg)



![Todas as soluções tem sempre o mesmo
valor de pH?
o que significa?
sal formado = base forte (NaOH) + ácido
forte (HCl) = 100% dissociados em solução
= [H+
] e [OH-
] livres são iguais
pH reflete a neutralidade da solução
Propriedades ácido- base de soluções de sais
NaCl em água, qual é o pH?
1 2 3 4
5 6 7 8
9 10 11 12
pH=7,0](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-29-320.jpg)

![Propriedades ácido - base das soluções
dependem da reação dos íons com a
água produzindo H+
ou OH-
= hidrólise.
Solução de sais derivados de um ácido
forte e de uma base forte = neutra [p.ex.
NaCl, Ca(NO3)2].
Solução de sais derivados de uma base
forte e de um ácido fraco = básica [p.ex.
NaOCl, Ba(C2H3O2)2].
Solução de sais derivados de uma base
fraca e de um ácido forte = ácida [p.ex.
NH4Cl, Al(NO3)3].
Solução de sais derivados de um ácido
fraco e de uma base fraca = pode ser
ácida ou básica = Regras do equilíbrio.
Propriedades ácido- base de
soluções de sais](https://image.slidesharecdn.com/equilibrioacidobase-250324184356-01f3eb94/85/Equilibrio-Acido-Base-pptx-Bioquimica-nutricional-31-320.jpg)