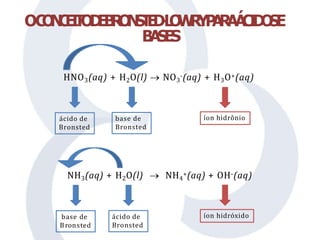
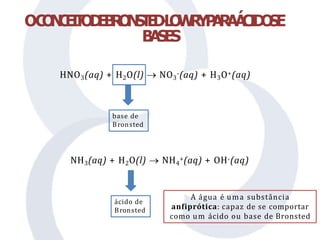
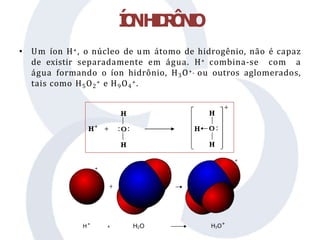
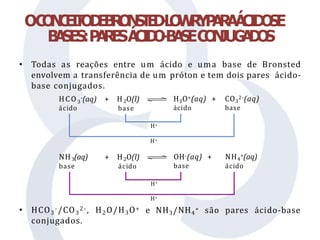
O documento discute teorias sobre ácidos e bases, incluindo os conceitos de Arrhenius, Brønsted-Lowry e Lewis. Arrhenius define ácidos como doadores de íons H+ em água e bases como doadores de íons OH-. A teoria de Brønsted-Lowry amplia essa definição, considerando ácidos como doadores de prótons e bases como aceitantes de prótons, enquanto a teoria de Lewis define ácidos como aceitantes de elétrons e bases como doadores de elétrons.










![OC
O
N
C
E
I
T
O
D
E
B
R
O
N
S
T
E
D
-
L
O
W
R
YP
A
R
AÁ
C
I
D
O
SE
B
A
SES:F
O
R
Ç
A
SR
E
L
A
T
I
V
A
SD
EÁ
C
I
D
O
SEB
A
SES
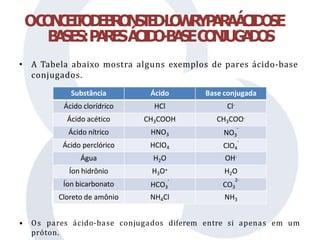
• A força relativa de um ácido ou de uma base pode ser
expressa quantitativamente com uma constante de equilíbrio.
• Ka é uma constante de equilíbrio para um ácido em água.
• Para um ácido fraco, Ka < 1.
• O valor de Ka aumenta a medida que aumenta a força do ácido, ou
seja, a medida que o ácido ioniza-se em maior extensão.
HA(aq) + H2O(l) A-(aq) + H3O+(aq) Ka = [A-][H3O+]/[HA]](https://image.slidesharecdn.com/aula4-acidosebases-230302213736-9f793e67/85/aula-4-acidos-e-bases-pptx-16-320.jpg)
![OC
O
N
C
E
I
T
O
D
E
B
R
O
N
S
T
E
D
-
L
O
W
R
YP
A
R
AÁ
C
I
D
O
SE
B
A
SES:F
O
R
Ç
A
SR
E
L
A
T
I
V
A
SD
EÁ
C
I
D
O
SEB
A
SES
• Do mesmo modo, podemos escrever a constante de equilíbrio
para uma base, Kb.
• A Tabela a seguir mostra alguns ácidos e bases ordenados em
função de sua capacidade de doar ou aceitar prótons e seus
respectivos valores de Ka e Kb.
• Observa-se que quanto mais fraco é ácido, mais forte é sua
base conjugada. Ou seja, quanto menor o valor de Ka, maior o
valor de Kb correspondente.
B(aq) + H2O(l) BH+(aq) + OH-(aq) Kb = [BH+][OH-]/[B]](https://image.slidesharecdn.com/aula4-acidosebases-230302213736-9f793e67/85/aula-4-acidos-e-bases-pptx-17-320.jpg)
![AÁ
G
U
AEAE
S
C
A
LAD
Ep
H
2H2O(aq) H3O+(aq) + OH-(aq)
auto-ionização da água
Kw = [H3O+][OH-]
Kw = 1,0 x 10-14 (a 25 oC)
[H3O+] = [OH-]= 1,0 x 10-7 (solução
neutra)
[H3O+]>[OH-] (solução ácida)
[H3O+]<[OH-] (solução básica)
pH = -log [H3O+]
pOH = -log [OH-]
Em água pura, a 25 oC
pH = pOH- = 7,0](https://image.slidesharecdn.com/aula4-acidosebases-230302213736-9f793e67/85/aula-4-acidos-e-bases-pptx-19-320.jpg)
