O documento discute conceitos fundamentais de equilíbrio químico, incluindo:
1) Definições de ácidos e bases segundo as teorias de Arrhenius, Brønsted-Lowry e Lewis;
2) Constante de dissociação de ácidos (Ka) e constante de equilíbrio de bases (Kb);
3) Relação entre Ka e Kb e a constante do produto iônico da água (Kw);
4) Cálculo do pH em soluções tampão usando a equação de Henderson-Hasselbalch



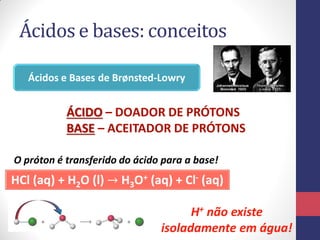

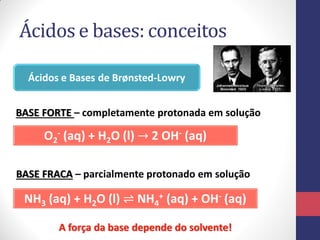

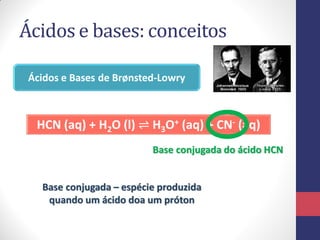
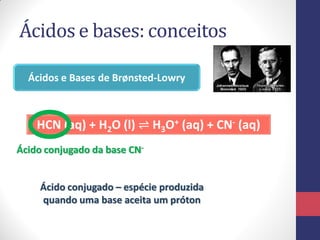





![A Escala de pH
pH = -log [H3O+] pOH = -log [OH-]
Para a água pura, a molaridade dos íons H3O+ é
𝟏, 𝟎 𝒙 𝟏𝟎−𝟕
𝒎𝒐𝒍 𝑳−𝟏
, em 25°C. Seu pH será:
pH = -log [H3O+] = -log (1,0 x 10-7) = 7,0
• O pH da água pura é 7
• O pH de uma solução ácida é menor do que 7
• O pH de uma solução básica é maior do que 7](https://image.slidesharecdn.com/equilbrioqumicoparteiiparablog-130614151020-phpapp02/85/Aulas-de-Equilibrio-quimico-Parte-II-15-320.jpg)

![A auto-ionização da água
2 H2O ⇌ H3O+ + OH-
CONSTANTE DO PRODUTO IÔNICO DA ÁGUA- Kw
Solução neutra a 25°C:
[H3O+] = [OH-] = 1,00 x 10-7 M
pH = pOH = 7,00
pH + pOH = pKw = 14,00](https://image.slidesharecdn.com/equilbrioqumicoparteiiparablog-130614151020-phpapp02/85/Aulas-de-Equilibrio-quimico-Parte-II-17-320.jpg)






![Equação de Henderson-
Hasselbalch
𝑝𝐻 = 𝑝𝐾𝑎 + 𝑙𝑜𝑔
[𝑏á𝑠𝑖𝑐𝑜]𝑖𝑛𝑖𝑐𝑖𝑎𝑙
[á𝑐𝑖𝑑𝑜]𝑖𝑛𝑖𝑐𝑖𝑎𝑙](https://image.slidesharecdn.com/equilbrioqumicoparteiiparablog-130614151020-phpapp02/85/Aulas-de-Equilibrio-quimico-Parte-II-24-320.jpg)