O equilíbrio químico foi estudado pela primeira vez em 1803 e ocorre quando as velocidades das reações direta e inversa são iguais, mantendo as concentrações constantes ao longo do tempo. Representa um estado dinâmico no qual as transformações nos sentidos direto e inverso ocorrem simultaneamente de forma contínua.


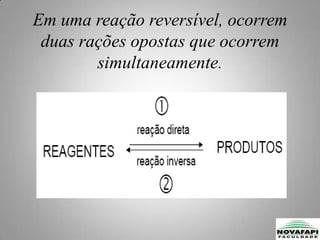

![O coeficiente da reação e a Constante de equilíbrioObservem a reação química do tipo[A][B][C] e [D] são concentrações que participam da reação em um dado instante.](https://image.slidesharecdn.com/equilibrioquimico-100827094402-phpapp02/85/Equilibrio-quimicoRUDSON000-5-320.jpg)

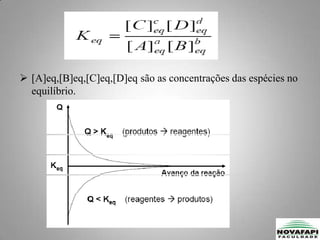
![O valor de Q recebe o nome de constante de equilíbrio, Keq:[A]eq,[B]eq,[C]eq,[D]eq são as concentrações das espécies no equilíbrio.Equilíbrio Químico X TermodinâmicaEquilíbrio QuímicoÉ uma das aplicações mais importantes dentro da Termodinâmica, quando diz que o sistema esta em equilíbrio é porque ele esta em estado de “descanso”.](https://image.slidesharecdn.com/equilibrioquimico-100827094402-phpapp02/85/Equilibrio-quimicoRUDSON000-7-320.jpg)



![Equilíbrio Químico E CinéticaA velocidade reação direta v1, é função das concentrações dos reagentes A e B na mistura reacional: V₁ = k₁[A].[B]](https://image.slidesharecdn.com/equilibrioquimico-100827094402-phpapp02/85/Equilibrio-quimicoRUDSON000-12-320.jpg)
![A velocidade reação inversa v2, é a função das concentrações C e D na mistura reacional: V₂ = k₂ [C].[D]](https://image.slidesharecdn.com/equilibrioquimico-100827094402-phpapp02/85/Equilibrio-quimicoRUDSON000-13-320.jpg)


