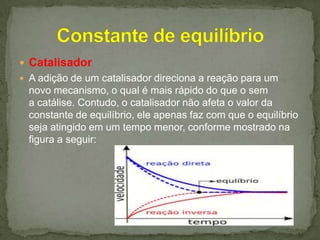
O documento discute o equilíbrio químico, definindo-o como a situação em que a proporção entre reagentes e produtos permanece constante ao longo do tempo. Aborda conceitos como reversibilidade de reações, constante de equilíbrio e como fatores como temperatura e catalisador podem deslocar o equilíbrio. Fornece exemplos como a evaporação da água para ilustrar reações reversíveis em equilíbrio.