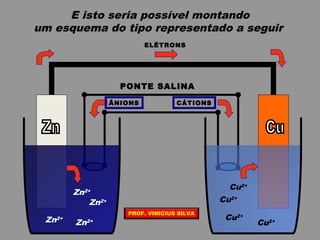
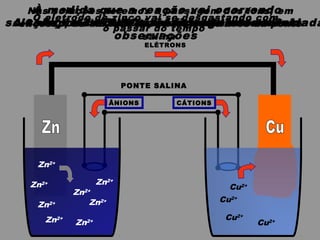
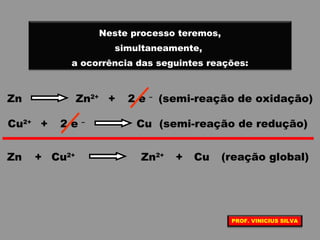
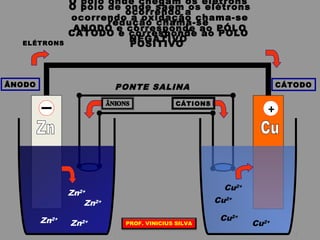
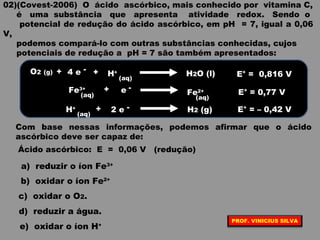
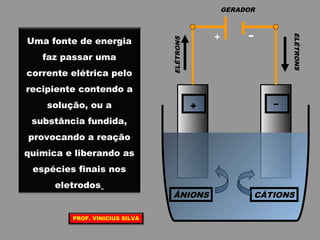
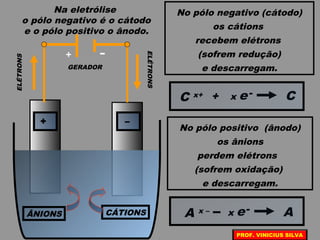
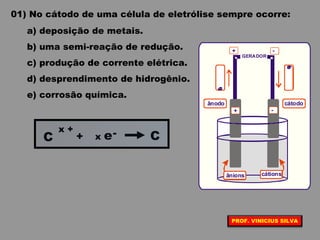
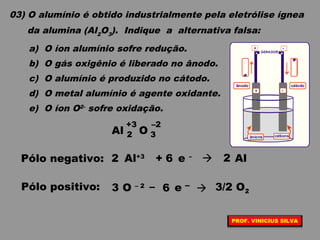
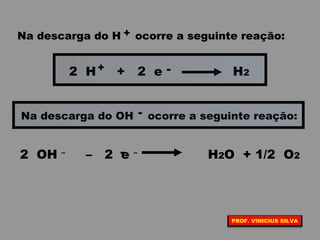
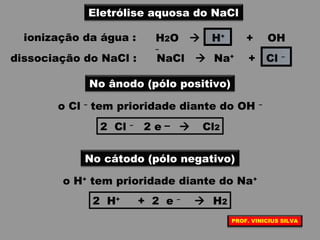
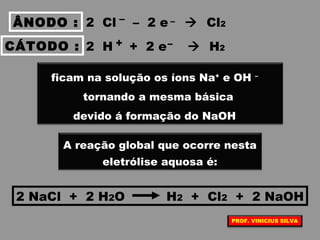
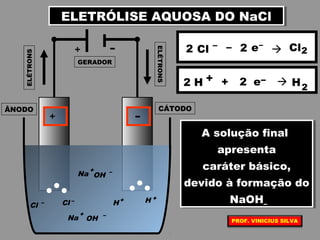
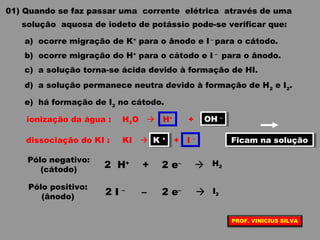
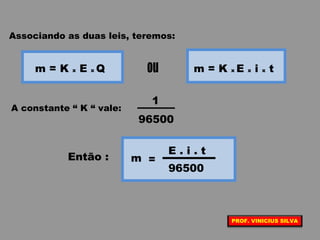
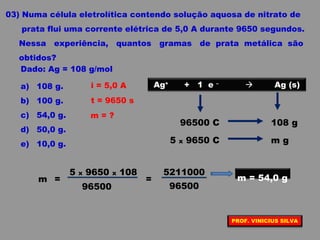
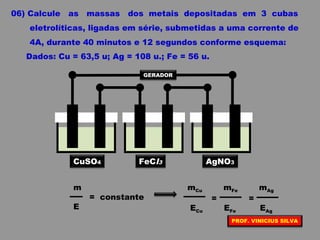
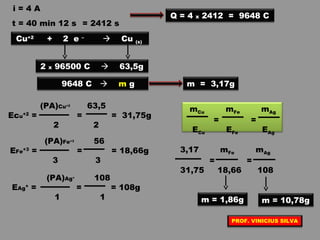
O documento discute as relações entre reações químicas e corrente elétrica. A eletroquímica estuda esta relação, onde reações de óxido-redução espontâneas produzem energia elétrica em pilhas e corrente elétrica provoca reações químicas em eletrólises. A pilha de Daniell é usada como exemplo de pilha eletroquímica.