O documento discute os principais conceitos de equilíbrio químico, incluindo noções de equilíbrio químico, constante de equilíbrio, equilíbrio iônico em solução aquosa, equilíbrio ácido-base e solução tampão. Também aborda os efeitos da concentração, pressão e temperatura no equilíbrio químico de acordo com o Princípio de Le Chatelier.









![Constante de equilíbrio
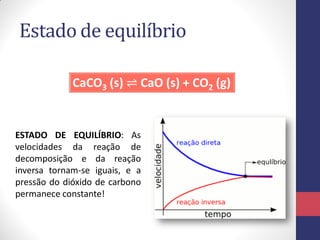
CaCO3 (s) ⇌ CaO (s) + CO2 (g)
𝐾 =
𝐶𝑎𝑂 𝐶𝑂2
𝐶𝑎𝐶𝑂3
𝐶𝑂2 =
[𝐶𝑎𝐶𝑂3]
[𝐶𝑎𝑂]
𝐾′ ≡ 𝐾
𝐶𝑂2 = 𝐾](https://image.slidesharecdn.com/equilbrioqumicoparteiparablog-130614150342-phpapp02/85/Aulas-de-Equilibrio-Quimico-Parte-I-12-320.jpg)
![Constante de equilíbrio
Cu2+ (aq) + Zn (s) ⇌ Cu (s) + Zn2+ (aq)
𝐾 =
𝐶𝑢 𝑍𝑛2+
𝐶𝑢2+ [𝑍𝑛]
[𝑍𝑛2+]
[𝐶𝑢2+]
=
[𝐶𝑢]
[𝑍𝑛]
𝐾′ ≡ 𝐾
[𝑍𝑛2+]
[𝐶𝑢2+]
= 𝐾](https://image.slidesharecdn.com/equilbrioqumicoparteiparablog-130614150342-phpapp02/85/Aulas-de-Equilibrio-Quimico-Parte-I-13-320.jpg)
![Constante de equilíbrio
2H2 (g) + O2 (g) ⇌ 2H2O (g)
H2 (g) +
𝟏
𝟐
O2 (g) ⇌ H2O (g)
𝐾1 =
[𝐻2 𝑂]2
[𝐻2]2[𝑂2]
𝐾2 =
[𝐻2 𝑂]
[𝐻2][𝑂2]1 2
𝐾2 = 𝐾1
1 2](https://image.slidesharecdn.com/equilbrioqumicoparteiparablog-130614150342-phpapp02/85/Aulas-de-Equilibrio-Quimico-Parte-I-14-320.jpg)
![Constante de equilíbrio
2NO (g) + O2 (g) ⇌ 2NO2 (g)
2NO2 (g) ⇌ 2NO (g) + O2 (g)
𝐾1 =
[𝑁𝑂2]2
[𝑁𝑂]2[𝑂2]
𝐾2 =
[𝑁𝑂]2
[𝑂2]
[𝑁𝑂2]2
𝐾2 =
1
𝐾1](https://image.slidesharecdn.com/equilbrioqumicoparteiparablog-130614150342-phpapp02/85/Aulas-de-Equilibrio-Quimico-Parte-I-15-320.jpg)
![Constante de equilíbrio
2NO (g) + O2 (g) ⇌ 2NO2 (g)
2NO2 (g) ⇌ N2O4 (g)
𝐾1 =
[𝑁𝑂2]2
[𝑁𝑂]2[𝑂2]
𝐾2 =
[𝑁2 𝑂4]
[𝑁𝑂2]2
𝐾3 = 𝐾1 𝐾2
2NO (g) + O2 (g) ⇌ N2O4 (g)
𝐾3 =
[𝑁2 𝑂4]
[𝑁𝑂]2[𝑂2]
=
[𝑁𝑂2]2
[𝑁𝑂]2[𝑂2]
[𝑁2 𝑂4]
[𝑁𝑂2]2](https://image.slidesharecdn.com/equilbrioqumicoparteiparablog-130614150342-phpapp02/85/Aulas-de-Equilibrio-Quimico-Parte-I-16-320.jpg)











![Galo do tempo
[𝑪𝒐𝑪𝒍 𝟒] 𝟐−
(𝒂𝒒)
+ 𝟔𝑯 𝟐 𝑶 (𝒍) ⇌ [𝑪𝒐(𝑯 𝟐 𝑶) 𝟔] 𝟐+
(𝒂𝒒)
+ 𝟒𝑪𝒍−
(𝒂𝒒)
AZUL ROSA](https://image.slidesharecdn.com/equilbrioqumicoparteiparablog-130614150342-phpapp02/85/Aulas-de-Equilibrio-Quimico-Parte-I-30-320.jpg)






![Sais pouco solúveis
AgCl (s) ⇌ Ag+ (aq) + Cl- (aq)
𝐾 =
𝐴𝑔+
𝐶𝑙−
[𝐴𝑔𝐶𝑙(𝑠)]
𝐾𝑝𝑠 = 𝐴𝑔+
𝐶𝑙−
PRODUTO DE
SOLUBILIDADE](https://image.slidesharecdn.com/equilbrioqumicoparteiparablog-130614150342-phpapp02/85/Aulas-de-Equilibrio-Quimico-Parte-I-37-320.jpg)
![Sais pouco solúveis
AgCl (s) ⇌ Ag+ (aq) + Cl- (aq)
𝐴𝑔+
𝐶𝑙−
= 𝐾𝑝𝑠 = 1,8 𝑥 10−10
Qual a
solubilidade
do AgCl em
água?
𝐴𝑔+
𝐶𝑙−
= [𝐴𝑔+
]2
= 1,8 𝑥 10−10
[𝐴𝑔+
] = 1,3 𝑥 10−5
𝑀
𝑆𝑜𝑙𝑢𝑏𝑖𝑙𝑖𝑑𝑎𝑑𝑒 𝑑𝑜 𝐴𝑔𝐶𝑙 = 1,3 𝑥 10−5
𝑀](https://image.slidesharecdn.com/equilbrioqumicoparteiparablog-130614150342-phpapp02/85/Aulas-de-Equilibrio-Quimico-Parte-I-38-320.jpg)

