O documento discute diferentes tipos de reações químicas. Ele explica que reações completas convertem totalmente reagentes em produtos, enquanto reações reversíveis podem ocorrer em ambos os sentidos com rendimentos menores que 100%. A constante de equilíbrio de uma reação depende das concentrações ou pressões parciais dos componentes quando as velocidades direta e inversa são iguais.



![EQUILÍBRIO QUÍMICO Considerando-se uma reação química genérica: aA + bB xX + yY A velocidade direta será: v 1 = k 1 [A] a [B] b a qual diminui com o passar do tempo. A velocidade inversa será: v 2 = k 2 [X] x [Y] y que no início é nula e vai aumentanto !](https://image.slidesharecdn.com/equilibrio-quimico-parte-1-1194487063514814-2/85/Equilibrio-Quimico-Parte-1-6-320.jpg)
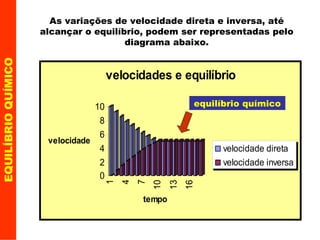
![A medida que a reação avança a velocidade direta vai diminuindo e a inversa aumentando , até o momento em que as duas tornam-se iguais e a velocidade global nula ! v direta = v inversa v 1 = k 1 [A] a [B] b e v 2 = k 2 [X] x [Y] y Esse momento é chamado de Equilíbrio Químico . EQUILÍBRIO QUÍMICO](https://image.slidesharecdn.com/equilibrio-quimico-parte-1-1194487063514814-2/85/Equilibrio-Quimico-Parte-1-7-320.jpg)
![EQUILÍBRIO QUÍMICO Se as duas velocidades (direta e inversa) são iguais ao atingir o equilíbrio, então: v 1 = v 2 k 1 [A] a [B] b = k 2 [X] x [Y] y isolando os termos semelhantes resulta: C A a , C B b ,... = concentrações molares de A, B,... K c = constante de equilíbrio (concentrações) C A a = [A] a , ...](https://image.slidesharecdn.com/equilibrio-quimico-parte-1-1194487063514814-2/85/Equilibrio-Quimico-Parte-1-9-320.jpg)
![EQUILÍBRIO QUÍMICO Algumas reações e as constantes K c (em função de concentrações) Generalizando K c = [Produtos] p / [Reagentes] r Reação Constantes N 2 + 3H 2 2NH 3 K c = [NH 3 ] 2 / [N 2 ].[H 2 ] 3 PCl 5 PCl 3 + Cl 2 K c = [PCl 3 ].[Cl 2 ] / [PCl 5 ] SO 3 + 1/2 O 2 SO 3 K c = [SO 3 ] / [SO 2 ].[O 2 ] 1/2 2H 2 + S 2 2H 2 S K c = [H 2 S] 2 / [H 2 ] 2 .[S 2 ]](https://image.slidesharecdn.com/equilibrio-quimico-parte-1-1194487063514814-2/85/Equilibrio-Quimico-Parte-1-10-320.jpg)
![EQUILÍBRIO QUÍMICO Equilíbrio químico em reações gasosas Considere a formação da amônia, que ocorre em fase gasosa, num balão de volume V , em certa temperatura T sendo que cada gás exerce uma pressão parcial P x A pressão de cada gás pode ser calculada a partir da expressão: P = n x R T / V onde: n x / V = [X] logo: P = [X] R T [X] = molaridade ; R = constante dos gases e T = temperatura absoluta (K) N 2(g) + 3H 2(g) 2 NH 3(g)](https://image.slidesharecdn.com/equilibrio-quimico-parte-1-1194487063514814-2/85/Equilibrio-Quimico-Parte-1-11-320.jpg)

![EQUILÍBRIO QUÍMICO Cálculo da constante K c - exemplo A constante de equilíbrio será: K c = [PCl 3 ].[Cl 2 ] / [PCl 5 ] = [2,5].[2,5] / [0,5] K c = 12,5 mol/L O PCl 5 se decompõe, segundo a equação: PCl 5 PCl 3 + Cl 2 Ao iniciar havia 3,0 mols/L de PCl 5 e ao ser alcançado o equilíbrio restou 0,5 mol/L do reagente não transformado. Calcular K c .](https://image.slidesharecdn.com/equilibrio-quimico-parte-1-1194487063514814-2/85/Equilibrio-Quimico-Parte-1-13-320.jpg)
![EQUILÍBRIO QUÍMICO Equilíbrios em reações heterogêneas Há certas reações, nas quais se estabelece equilíbrio, em que reagentes e/ou produtos encontram-se em estados físicos distintos, como por exemplo: I - CaCO 3(s) CaO (s) + CO 2(g) II - NH 4 Cl (s) NH 3(g) + HCl (g) Nesses casos, como a concentração dos componentes sólidos não variam, as constantes não incluem tais componentes. I - K c = [CO 2 ] e K p = P CO2 II - K c = [NH 3 ].[HCl] e K p = P HCl . P NH3](https://image.slidesharecdn.com/equilibrio-quimico-parte-1-1194487063514814-2/85/Equilibrio-Quimico-Parte-1-14-320.jpg)