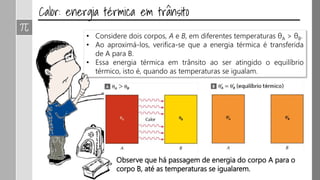
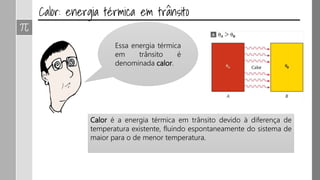
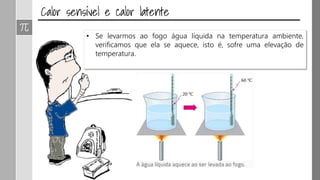
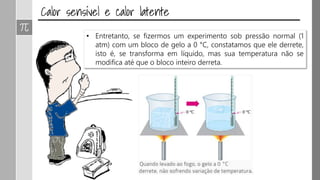
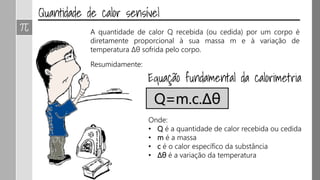
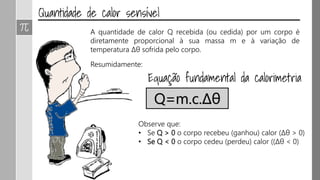
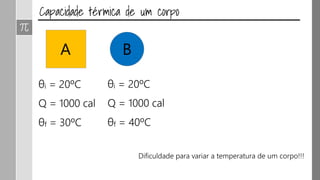
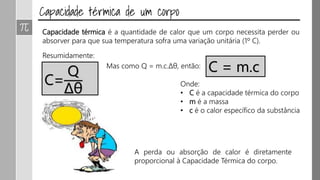
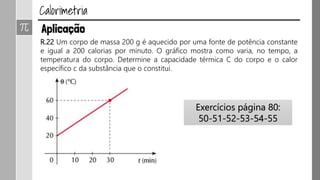
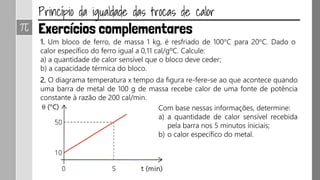
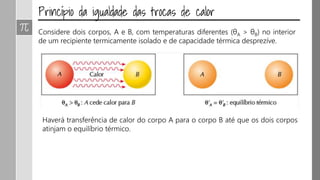
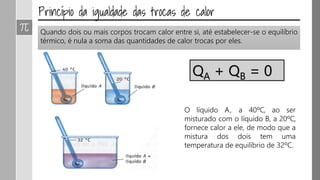
O documento discute os conceitos de calor, calor sensível, calor latente e capacidade térmica. Explica que calor é energia transferida devido à diferença de temperatura e que pode causar aumento de temperatura (calor sensível) ou mudança de estado (calor latente). Também define a equação para calcular a quantidade de calor Q = m × c × Δθ.