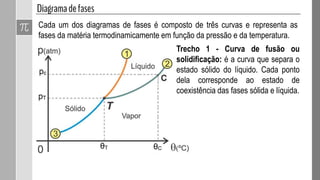
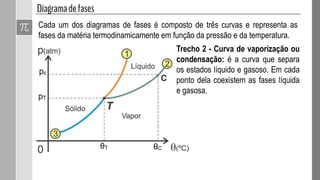
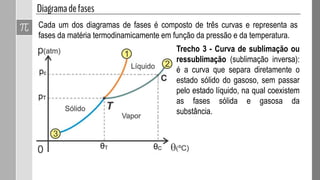
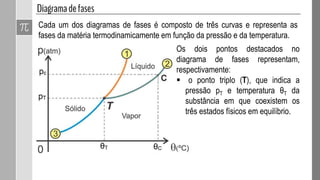
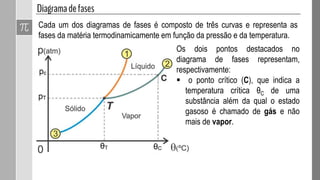
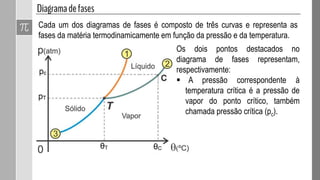
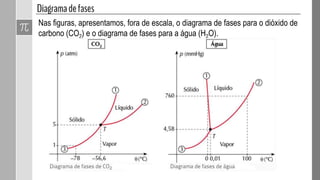
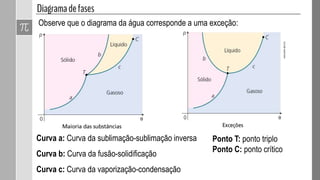
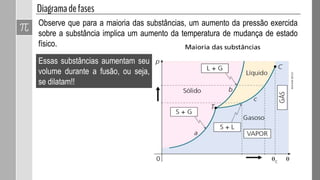
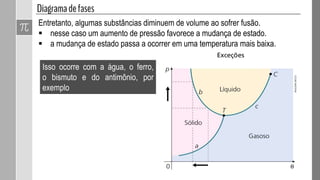
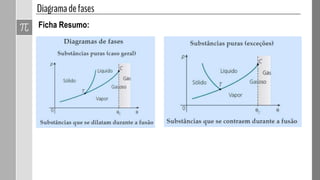
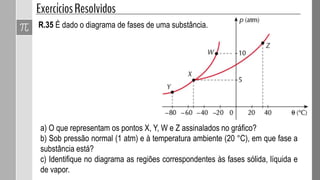
O documento discute as fases da matéria e diagramas de fases. Diagramas de fases são compostos por três curvas que representam as transições entre os estados sólido, líquido e gasoso em função da pressão e temperatura. Os pontos triplo e crítico indicam condições em que três ou duas fases coexistem em equilíbrio.