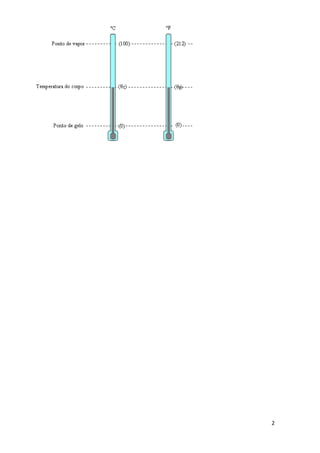
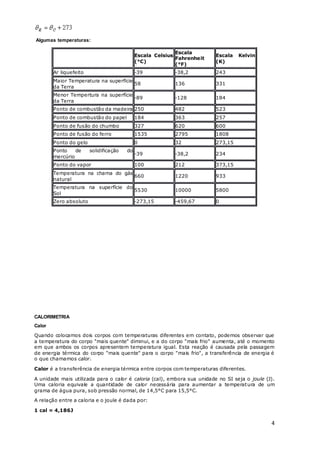
1. A temperatura é uma medida da agitação molecular de um corpo. Existem diferentes escalas para medir a temperatura, como Celsius, Fahrenheit e Kelvin.
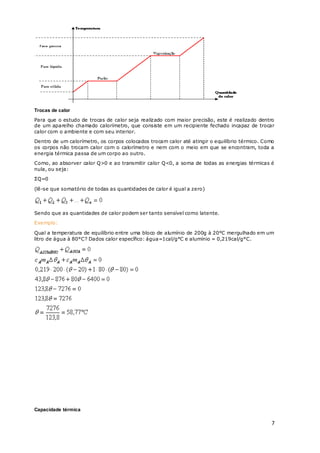
2. O calor é a transferência de energia térmica entre corpos com diferentes temperaturas. Pode ocorrer por condução, convecção ou irradiação.
3. A quantidade de calor absorvida ou cedida por um corpo pode causar mudanças de temperatura ou de estado físico.