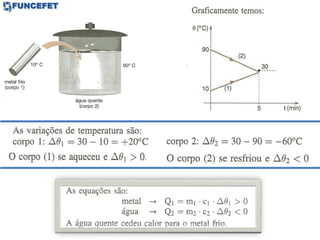
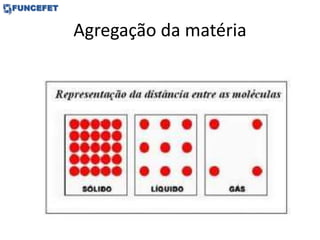
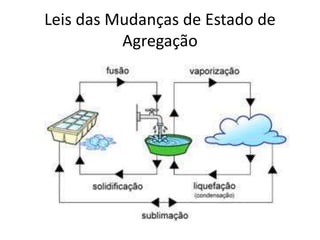
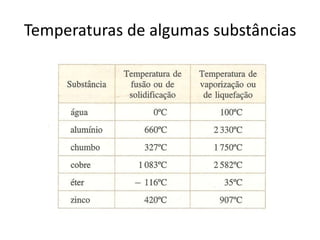
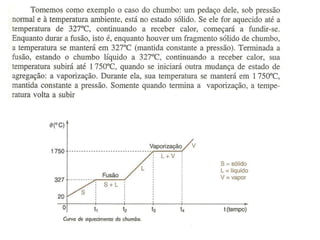
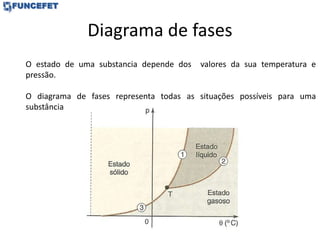
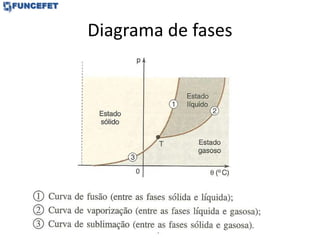
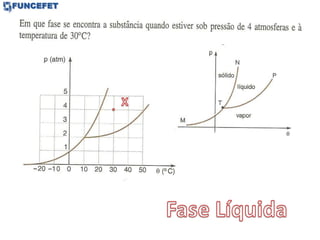
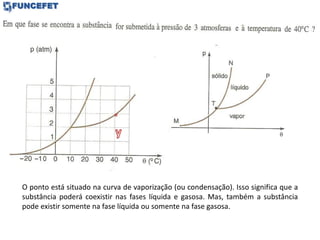
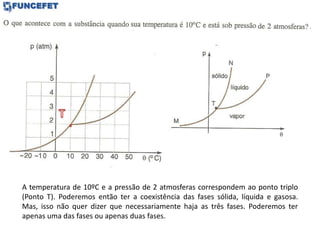
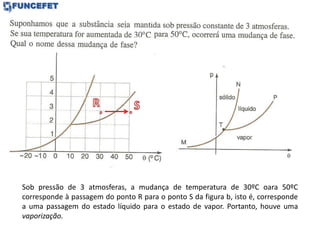
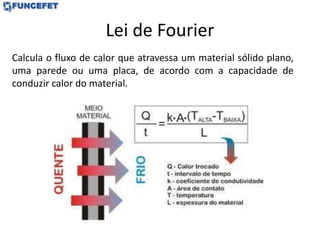
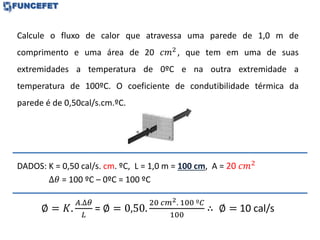
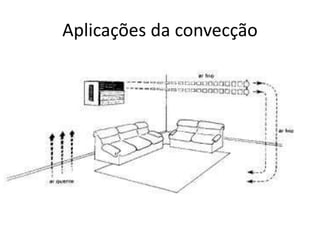
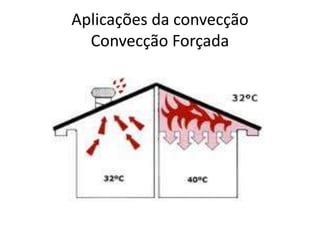
O documento discute os conceitos fundamentais de transmissão de calor, incluindo:
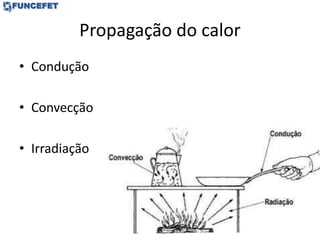
1) As formas de transferência de calor: condução, convecção e irradiação.
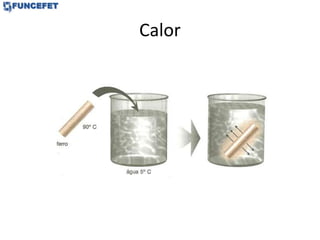
2) A definição de calor como energia transferida devido à diferença de temperatura.
3) As propriedades dos corpos quentes e frios durante a troca de calor.










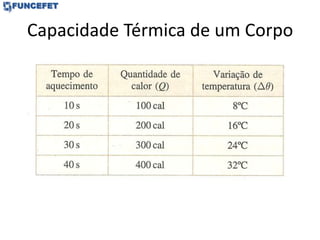
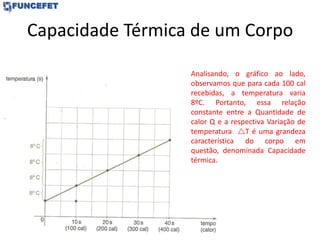


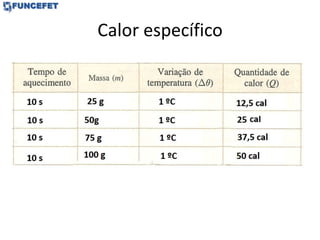

![Problemas
Fornecendo a um corpo de massa 1,0 kg uma quantidade de
calor igual a 5,0 kcal, sua temperatura aumenta de 20ºC para
60º, sem, contudo, mudar o estado de agregação. Determina:]
a)Sua capacidade térmica
b)O calor específico da substancia de que é constituído o corpo
Resolução:
Capacidade Térmica: 𝑪 =
𝑸
∆∅
m = 1,0 kg Q = 5,0 kcal T1 = 50ºC T2 = 60ºC
𝐶 =
5,0 𝐾𝑐𝑎𝑙
60−50
C = 0,5 kcal/ºC
Calor específico: c =
𝑪
𝒎
=
0,5 kcal/ºC
1,0 𝑘𝑔
= 0,5 kcal/ºC](https://image.slidesharecdn.com/quantidadedecalor-140603195955-phpapp01/85/Quantidade-de-calor-21-320.jpg)