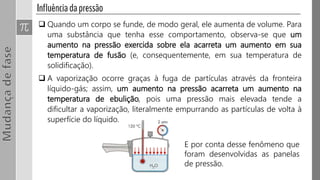
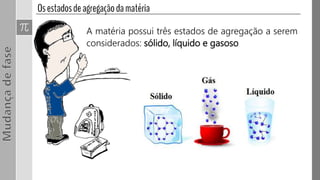
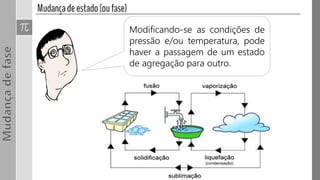
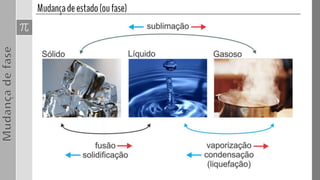
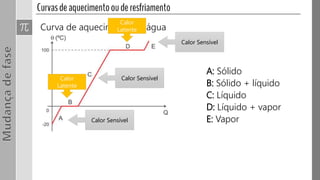
O documento discute os três estados da matéria - sólido, líquido e gasoso - e as mudanças entre eles através de processos como fusão, vaporização e sublimação. Quando a pressão e/ou temperatura são modificadas, uma substância pode mudar de estado, absorvendo ou liberando calor latente. Exemplos mostram cálculos envolvendo calor e mudanças de estado da água.





![R.29 Temos inicialmente 200 gramas de gelo a -10ºC. Determine a
quantidade de calor que essa massa de gelo deve receber para se
transformar em 200 g de água líquida a 20 °C. Trace a curva de
aquecimento desse processo.
[Dados: calor específico do gelo 0,5 cal/gºC calor específico da água
1 cal/gºC calor latente de fusão do gelo 80 cal/g]](https://image.slidesharecdn.com/003mudanadefase2017-170619101326/85/Mudanca-de-fase-2017-10-320.jpg)


![R.33 Um calorímetro de capacidade térmica desprezível tem no seu
interior uma pedra de gelo a -20ºC com 200 g de massa. Coloca-se
nesse calorímetro vapor de água a 100 °C, até que a temperatura do
sistema seja 60 °C. Sendo os calores latentes LF = 80 cal/g (fusão) e
LC = -540 cal/g (condensação), calcule a massa de água existente no
calorímetro quando o equilíbrio térmico é atingido. Considere os
calores específicos do gelo 0,5 cal/gºC e da água líquida 1 cal/gºC]
Exercícios página 102/103
83-84-85-86-88](https://image.slidesharecdn.com/003mudanadefase2017-170619101326/85/Mudanca-de-fase-2017-13-320.jpg)