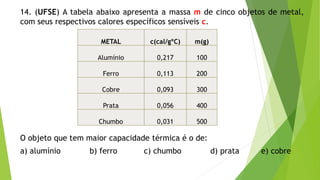
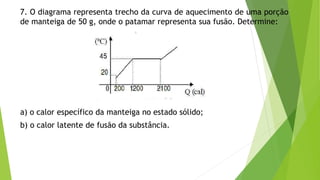
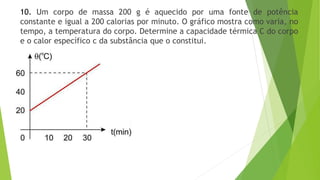
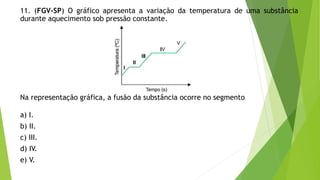
1) O documento contém 12 questões sobre transferência de calor e propriedades térmicas de substâncias como água, gelo e metais. As questões abordam tópicos como calor específico, calor latente, capacidade térmica e equilíbrio térmico.
2) São fornecidos dados como calores específicos, calores latentes e condições experimentais para o cálculo de quantidades de calor envolvidas em processos como fusão, vaporização e aquecimento de corpos.
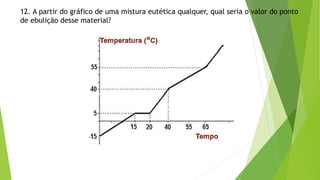
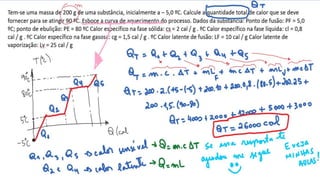
3) As questões pedem