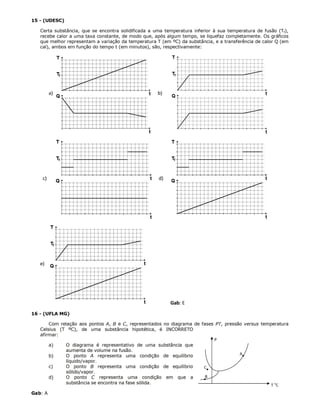
As 3 frases são:
Este documento contém 15 exercícios sobre propriedades térmicas e mudanças de estado da matéria. Os exercícios abordam tópicos como calor latente, calor específico, equilíbrio térmico e diagrama de fases. As questões devem ser respondidas com base em cálculos e no conhecimento desses conceitos físicos.