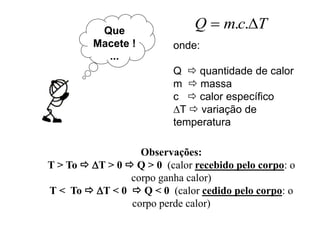
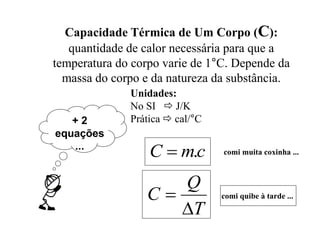
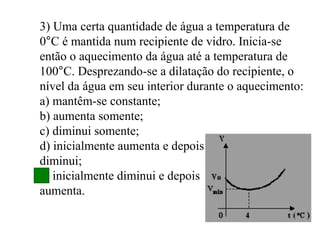
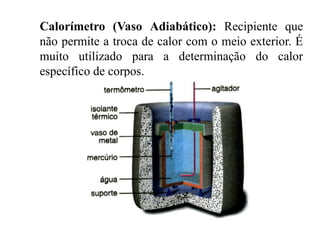
1) O documento descreve conceitos fundamentais de calorimetria como calor, calor sensível, calor latente, equação fundamental da calorimetria e capacidade térmica.
2) São apresentadas equações para calcular a quantidade de calor trocado entre corpos e a variação de temperatura resultante.
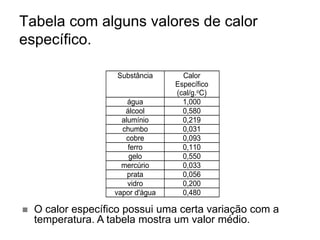
3) São listados alguns valores típicos de calor específico de diferentes substâncias.