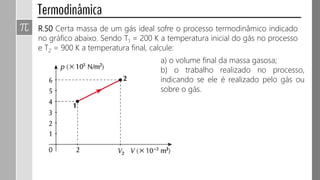
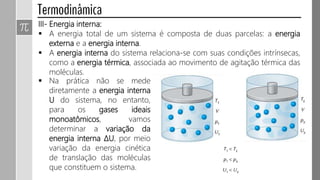
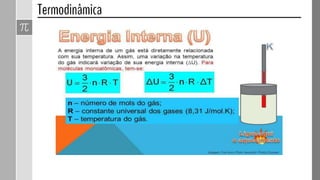
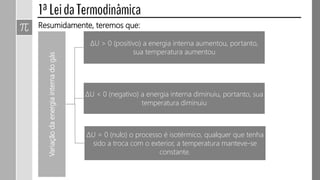
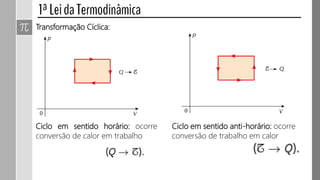
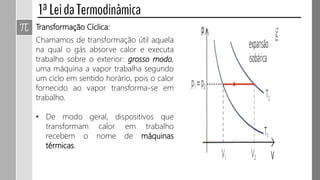
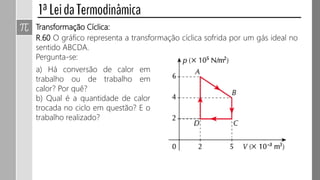
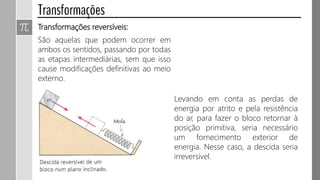
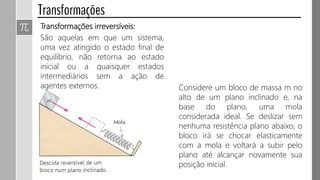
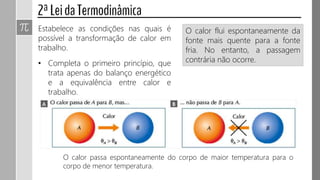
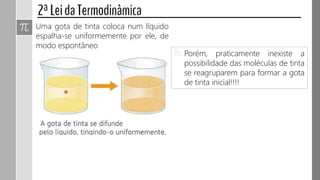
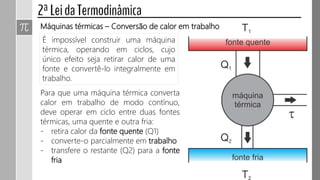
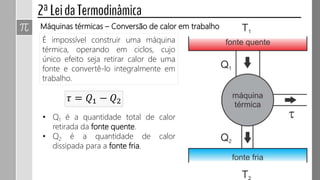
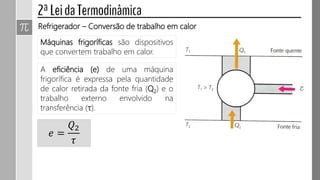
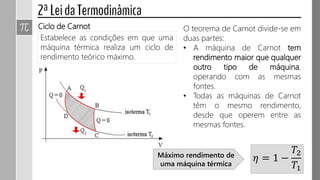
O documento descreve conceitos fundamentais da termodinâmica, incluindo:
1) Termodinâmica estuda as transformações entre calor e trabalho.
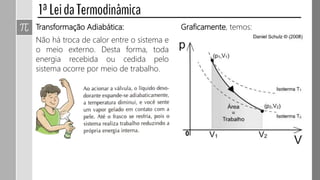
2) Sistemas podem ser isolados, fechados, abertos ou adiabáticos.
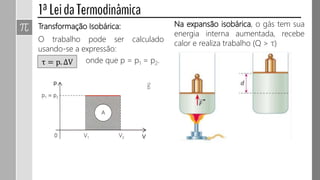
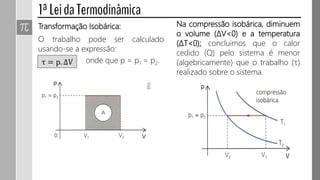
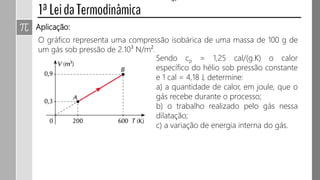
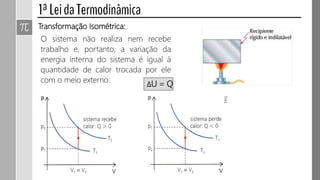
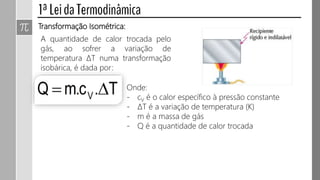
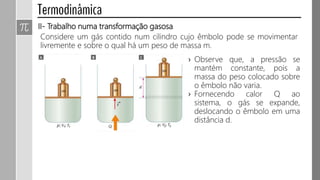
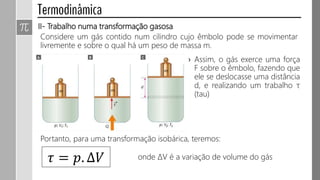
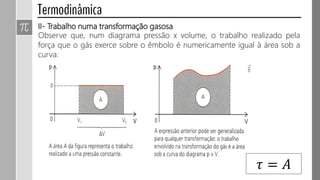
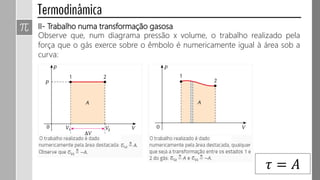
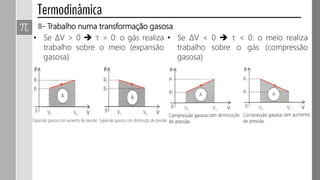
3) O trabalho realizado em uma transformação gasosa depende da variação de volume do gás.





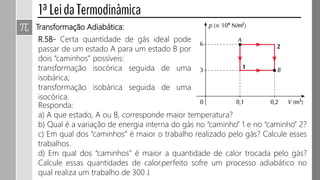
![R.49 Cinco mols de um gás ideal se encontram à temperatura de 600 K,
ocupando um volume de 0,5 m³. Mediante um processo isobárico, o gás é
submetido à transformação indicada no gráfico.
a) Determine a pressão exercida pelo gás
durante o processo.
b) Qual é a temperatura final do gás?
c) Calcule o trabalho realizado na
transformação, indicando como esse
cálculo pode ser feito por meio do gráfico.
d) O trabalho nesse processo isobárico é
realizado pelo gás ou sobre o gás?
Explique.
[Dado: R=8,31 J/(mol.K)]](https://image.slidesharecdn.com/000termodinmica2017-170927133843/85/Termodinamica-2017-11-320.jpg)