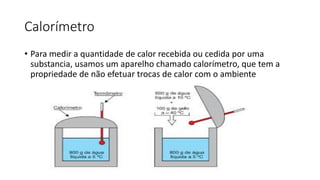
1) O documento discute termos e conceitos fundamentais da termologia e calorimetria, incluindo temperatura, calor, escalas termométricas, capacidade térmica, calor específico e equilíbrio térmico.
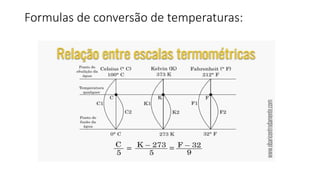
2) São apresentadas fórmulas para conversão de temperaturas entre escalas e cálculo de quantidade de calor, capacidade térmica e calor específico.
3) Há nove exercícios sobre aplicação destes conceitos em cálculos envolvendo aquecimento, resfriamento e mistura de substâncias