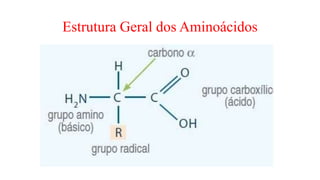
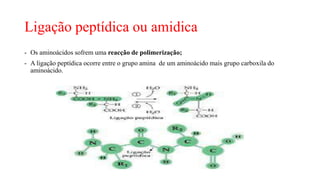
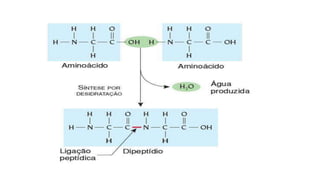
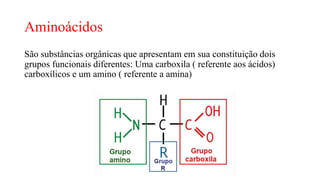
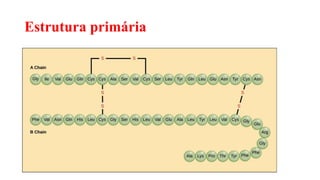
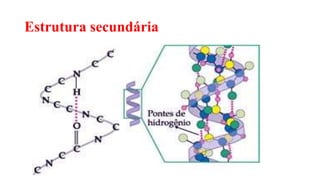
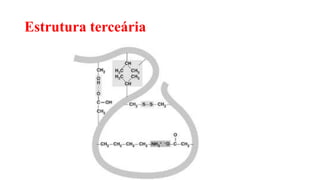
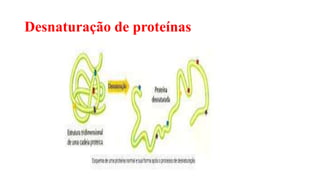
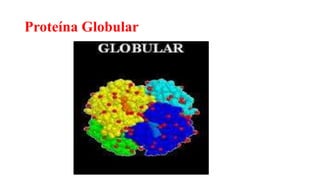
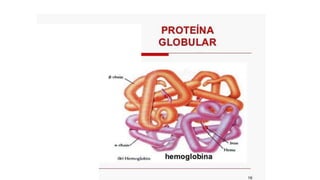
O documento descreve as características e estrutura das proteínas. As proteínas são compostos orgânicos abundantes nas células, formados pela união de aminoácidos através de ligações peptídicas. As proteínas possuem quatro níveis de estrutura - primária, secundária, terciária e quaternária - que determinam sua forma e função. As proteínas desempenham papéis estruturais e dinâmicos vitais nas células.