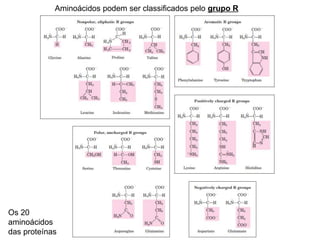
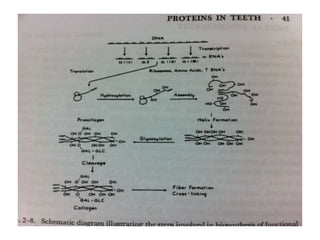
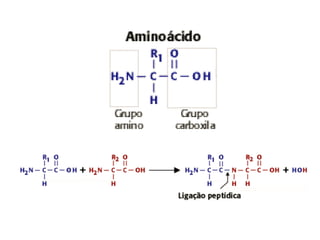
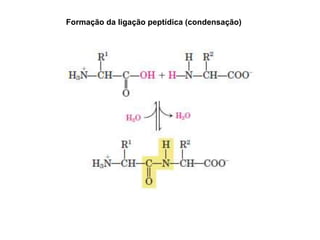
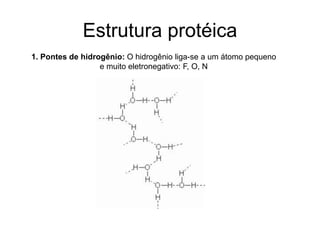
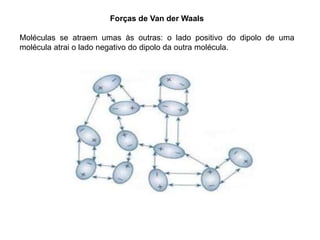
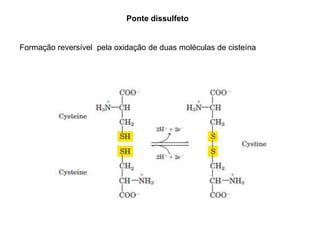
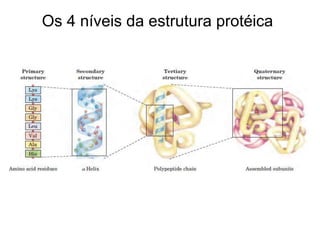
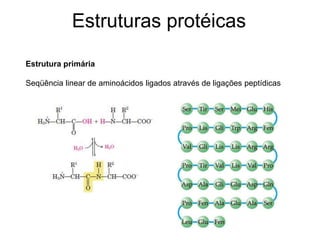
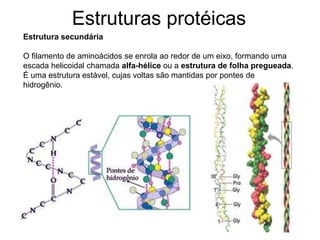
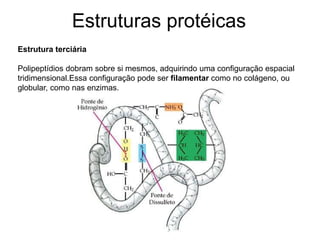
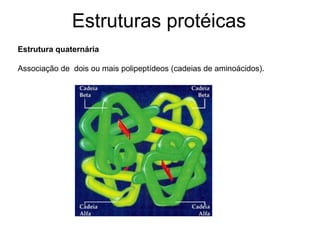
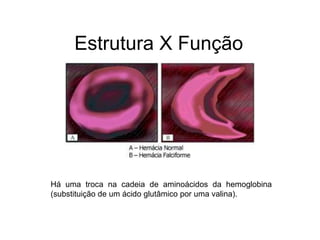
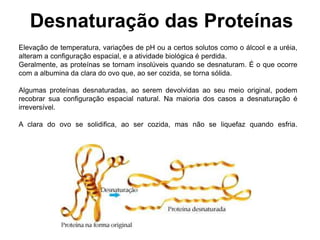
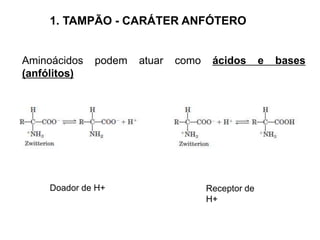
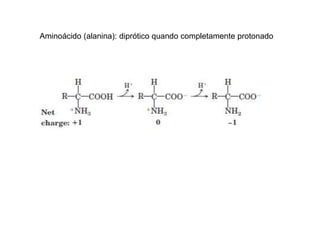
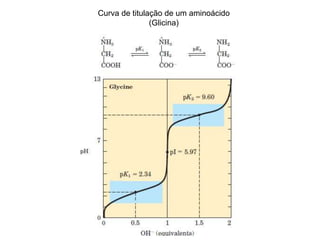
O documento descreve as funções e estruturas das proteínas. Apresenta suas principais funções como estrutural, transporte de gases, defesa, enzimática e hormonal. Descreve a estrutura primária, secundária, terciária e quaternária das proteínas, formadas por ligações entre aminoácidos. Explica como variações na sequência de aminoácidos podem afetar a estrutura e função da proteína, como no caso da hemoglobina.