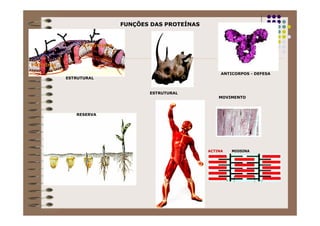
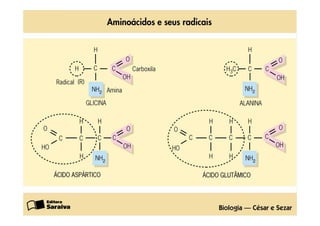
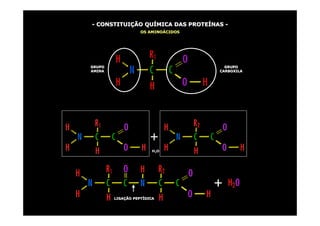
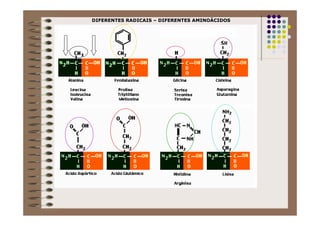
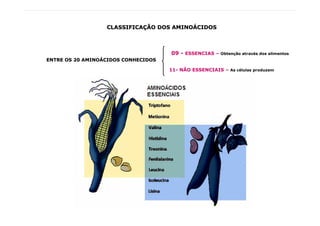
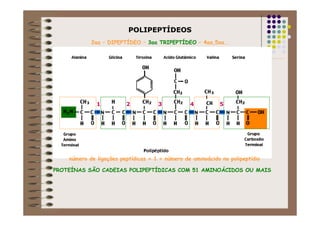
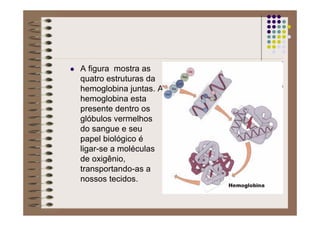
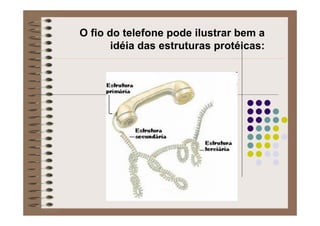
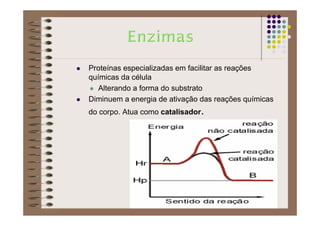
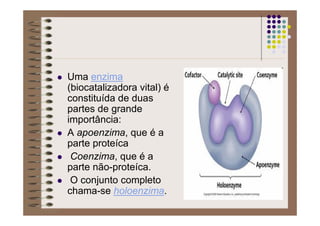
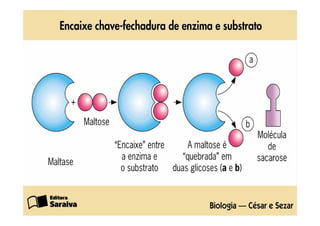
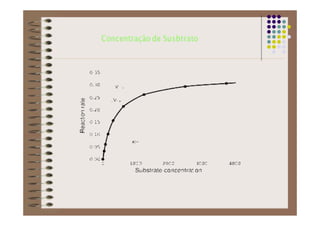
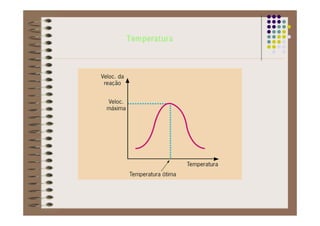
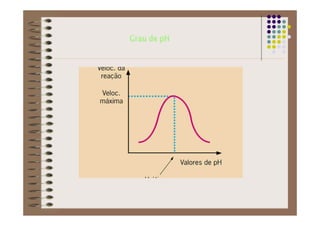
1) As proteínas são compostos orgânicos sintetizados pelos organismos vivos através da condensação de aminoácidos. 2) As proteínas têm diferentes funções estruturais, como dar rigidez aos tecidos, e funções como transporte de oxigênio e defesa do organismo. 3) As enzimas, que são proteínas, atuam como catalisadores em reações químicas, facilitando as reações no corpo.