Incorporar apresentação
Baixado 120 vezes



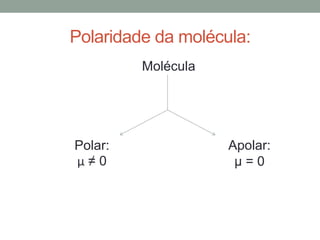
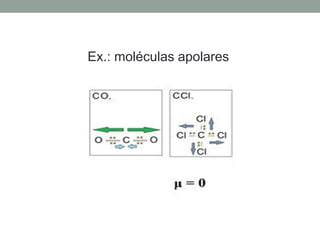
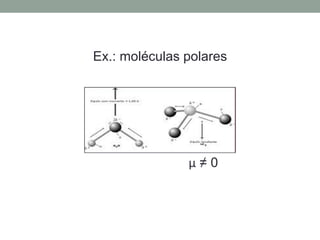

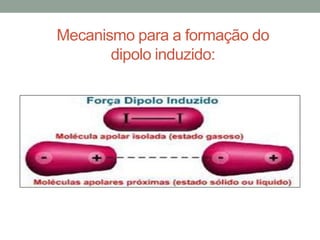
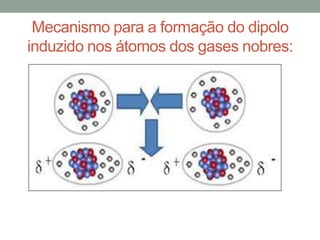


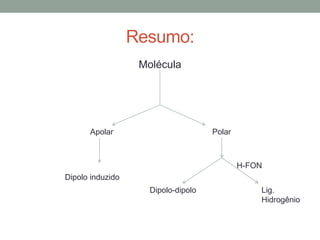

1) Interações intermoleculares são forças fracas que mantêm moléculas unidas e são conhecidas como interações de Van der Waals; 2) Existem três tipos principais: dipolo instantâneo-dipolo induzido entre moléculas apolares, dipolo permanente-dipolo permanente entre moléculas polares, e ligação de hidrogênio; 3) A polaridade da molécula depende se seu momento dipolar é nulo ou não, afetando o tipo de interação intermolecular.













