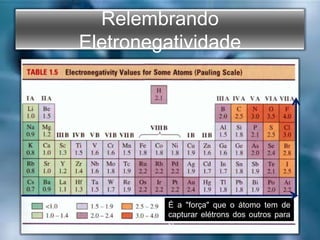
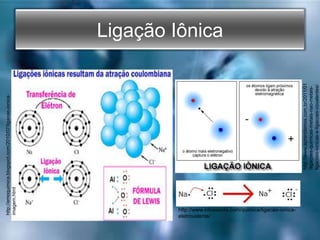
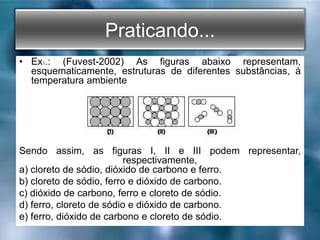
O documento descreve os três tipos principais de ligações químicas: iônica, covalente e metálica. A ligação iônica envolve a transferência de elétrons entre átomos e resulta em compostos iônicos sólidos. A ligação covalente envolve o compartilhamento de elétrons entre átomos e resulta em compostos moleculares com baixos pontos de fusão. A ligação metálica envolve um "mar" de elétrons que mantém os átomos metálicos coes