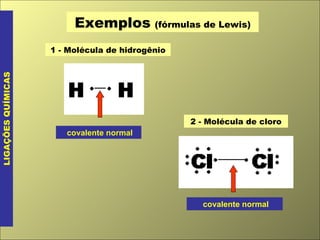
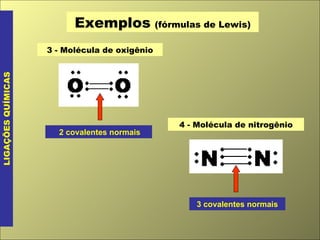
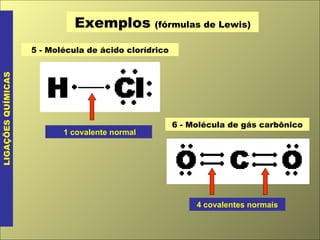
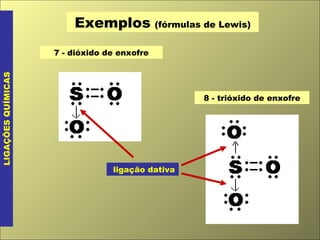
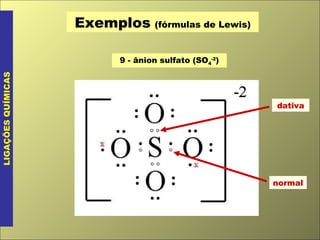
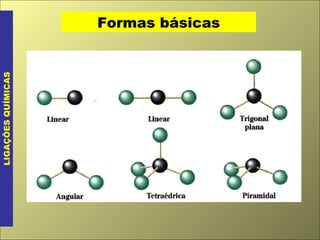
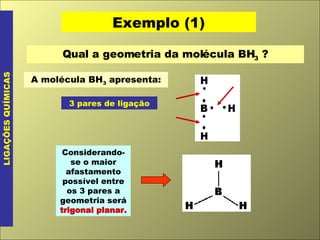
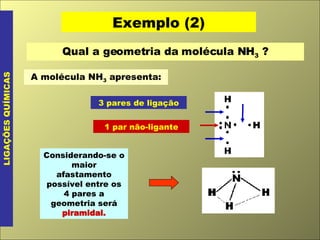
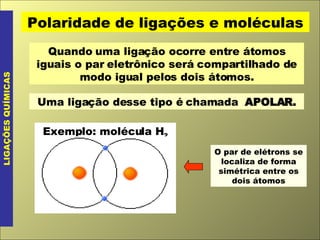
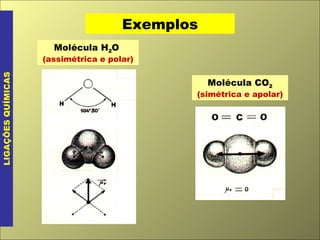
O documento discute os tipos de ligação química, incluindo ligação covalente normal e dativa. Explica que a geometria molecular é determinada pela Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência, que diz que os pares eletrônicos ao redor do átomo central se afastam o máximo possível. Também discute a polaridade de ligação e moléculas, dependendo da diferença de eletronegatividade entre os átomos.