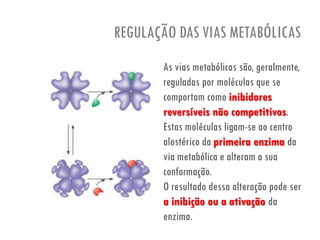
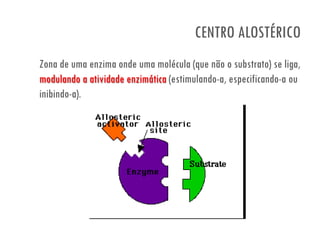
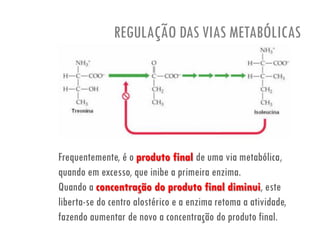
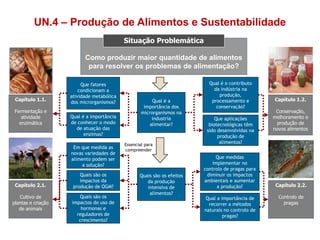
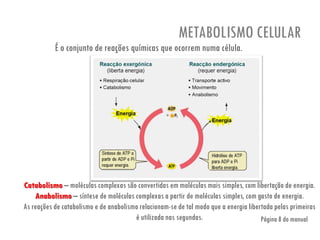
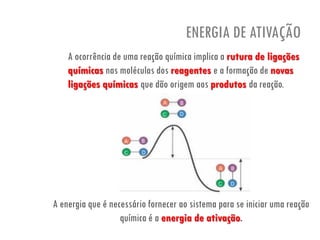
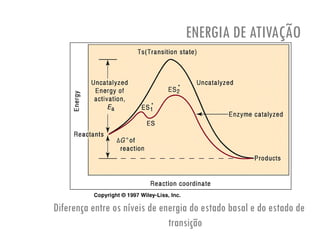
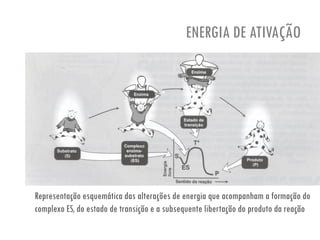
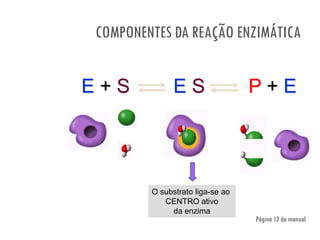
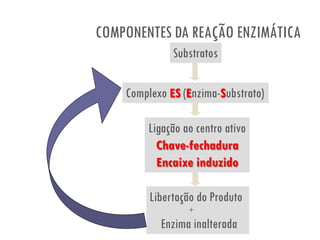
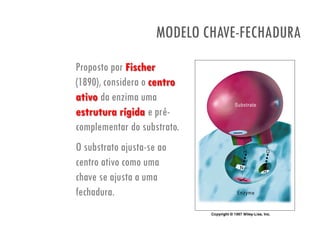
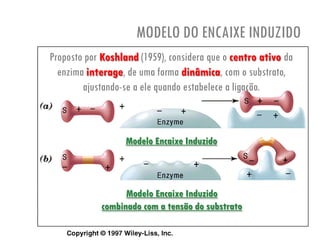
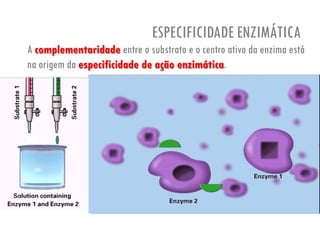
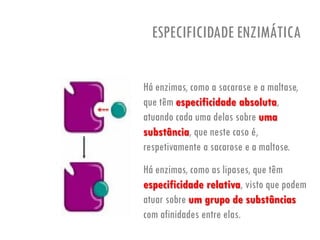
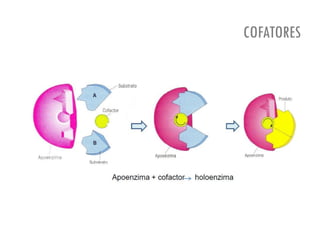
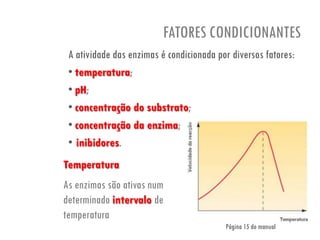
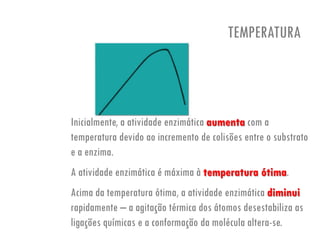
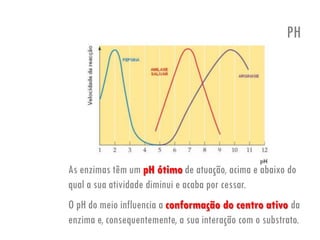
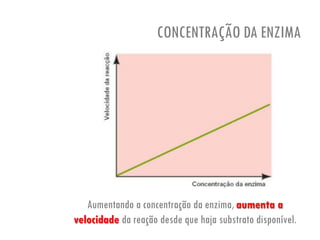
O documento discute a produção de alimentos e a atividade enzimática. Aborda a importância dos microrganismos na indústria alimentar, os fatores que afetam a atividade metabólica dos microrganismos, e as aplicações biotecnológicas desenvolvidas na produção de alimentos. Também discute os efeitos da produção intensiva de alimentos e as medidas para aumentar a produção de forma sustentável.















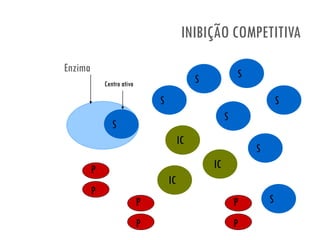


![INIBIÇÃO COMPETITIVA
[substrato] necessária para
que a enzima funcione
normalmente
afinidade da enzima pelo
substrato
Na presença do inibidor
competitivo
Análise Gráficav
V
V/2
Km Km s
Com inibidor
Sem inibidor
[s]](https://image.slidesharecdn.com/41-act-enzimas13-130425180252-phpapp02/85/41-act-enzimas13-36-320.jpg)
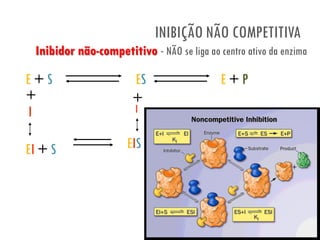
![• Inibidor não tem semelhança estrutural com o
substrato
• NÃO se liga ao centro ativo da enzima
• O aumento da [substrato] não diminui a inibição
• A VELOCIDADE máxima DIMINUI na presença do
inibidor
INIBIÇÃO NÃO COMPETITIVA](https://image.slidesharecdn.com/41-act-enzimas13-130425180252-phpapp02/85/41-act-enzimas13-38-320.jpg)
![INIBIÇÃO NÃO-COMPETITIVA
Diminui a concentração
de enzima ativa
Velocidade Máxima
da reação
Exemplos: Metais pesados - Pb+2
v
V
V
V/2
V/2
km [s]
Análise Gráfica
Com inibidor
Sem inibidor](https://image.slidesharecdn.com/41-act-enzimas13-130425180252-phpapp02/85/41-act-enzimas13-39-320.jpg)