1) O documento descreve os procedimentos de um laboratório de bioquímica clínica, incluindo tipos de amostras coletadas, equipamentos utilizados nos processos analíticos e pré/pós-analíticos, e métodos para realizar testes bioquímicos.
2) São detalhados processos de coleta, armazenamento e transporte de amostras para evitar erros, assim como técnicas para punção venosa, arterial e capilar.
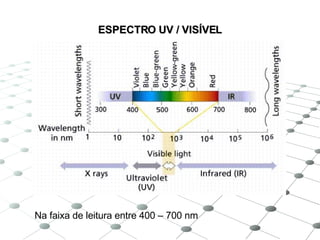
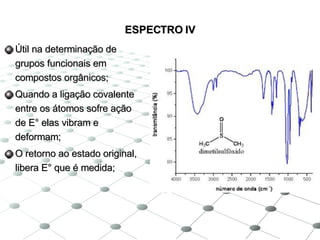
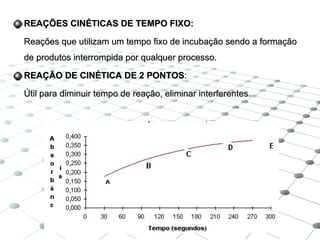
3) Os principais equipamentos descritos são espectrof