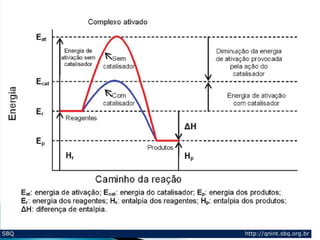
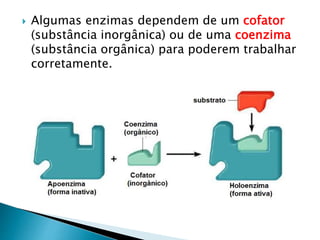
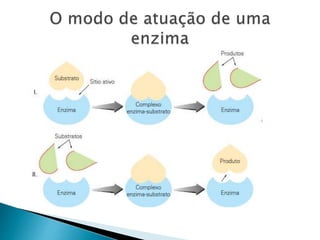
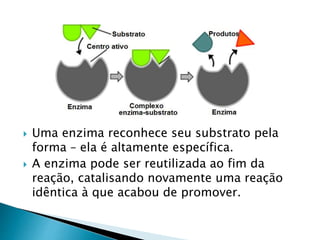
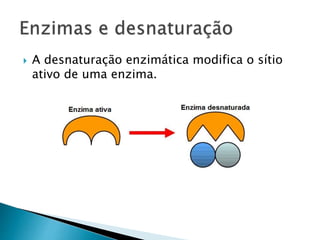
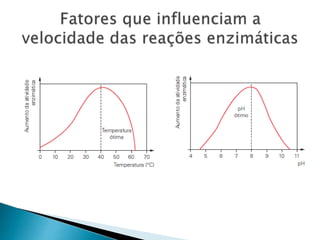
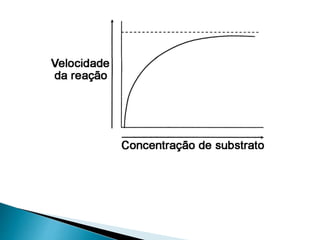
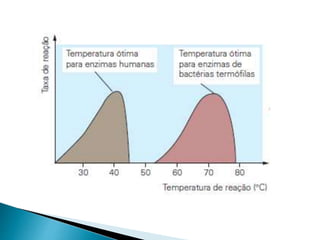
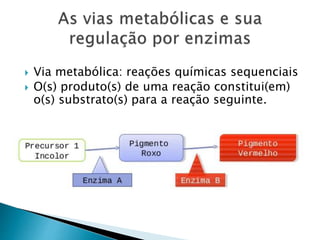
1) Enzimas são proteínas catalisadoras que aceleram reações químicas nos seres vivos e dependem de cofatores ou coenzimas para funcionar corretamente.
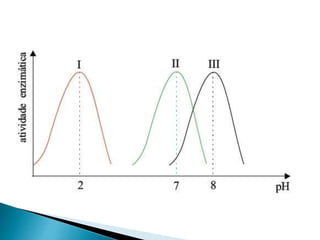
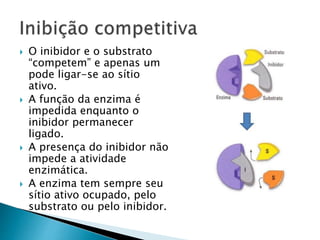
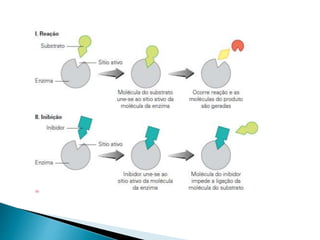
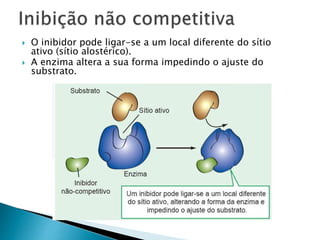
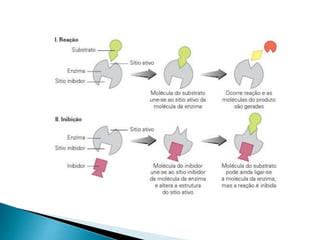
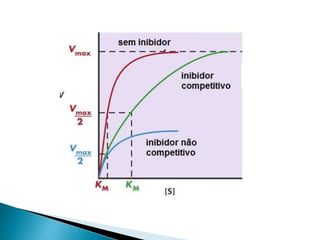
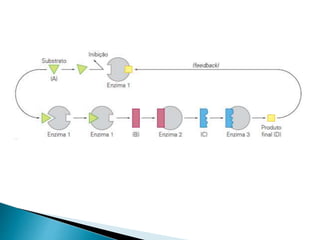
2) Existem diferentes tipos de regulação de enzimas, incluindo inibição competitiva e não competitiva que alteram a ligação do substrato ao sítio ativo.
3) Deficiências enzimáticas podem causar doenças, enquanto processos industriais as utilizam em diversas aplicações como alimentos, detergentes e medicamentos.