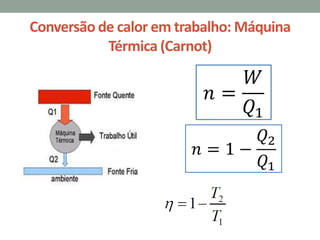
1) O documento discute conceitos fundamentais de termodinâmica, incluindo temperatura, calor, mudança de fase, leis da termodinâmica e máquinas térmicas.
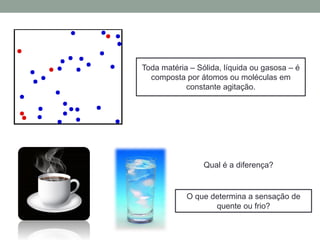
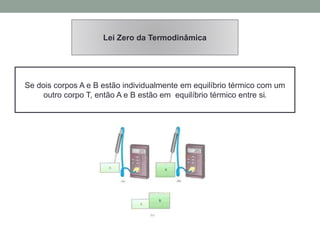
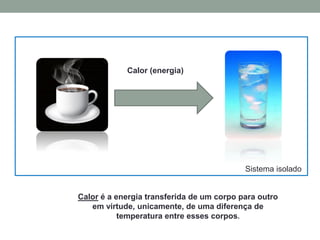
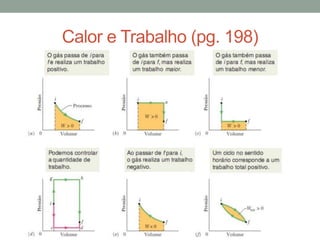
2) É explicado que temperatura mede o grau de agitação das partículas e que calor é energia transferida devido à diferença de temperatura.
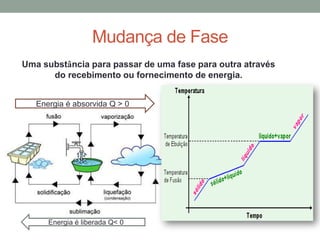
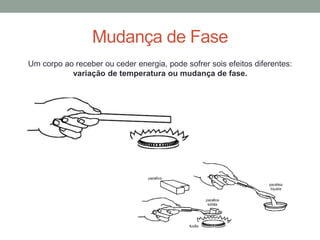
3) O conceito de calor latente é introduzido para descrever a energia necessária para mudança de estado da matéria.