Termodinâmica: Energia, Calor, Trabalho e Funções de Estado
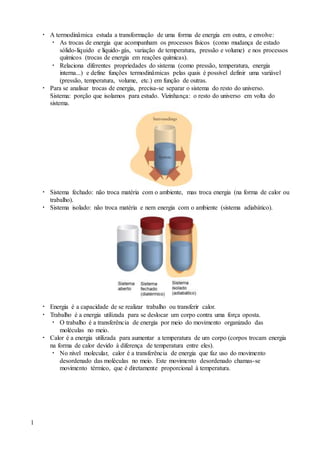
- 1. 1 A termodinâmica estuda a transformação de uma forma de energia em outra, e envolve: As trocas de energia que acompanham os processos físicos (como mudança de estado sólido-líquido e líquido-gás, variação de temperatura, pressão e volume) e nos processos químicos (trocas de energia em reações químicas). Relaciona diferentes propriedades do sistema (como pressão, temperatura, energia interna...) e define funções termodinâmicas pelas quais é possível definir uma variável (pressão, temperatura, volume, etc.) em função de outras. Para se analisar trocas de energia, precisa-se separar o sistema do resto do universo. Sistema: porção que isolamos para estudo. Vizinhança: o resto do universo em volta do sistema. Sistema fechado: não troca matéria com o ambiente, mas troca energia (na forma de calor ou trabalho). Sistema isolado: não troca matéria e nem energia com o ambiente (sistema adiabático). Energia é a capacidade de se realizar trabalho ou transferir calor. Trabalho é a energia utilizada para se deslocar um corpo contra uma força oposta. O trabalho é a transferência de energia por meio do movimento organizado das moléculas no meio. Calor é a energia utilizada para aumentar a temperatura de um corpo (corpos trocam energia na forma de calor devido à diferença de temperatura entre eles). No nível molecular, calor é a transferência de energia que faz uso do movimento desordenado das moléculas no meio. Este movimento desordenado chamas-se movimento térmico, que é diretamente proporcional à temperatura.
- 2. 2 Processo endotérmico: o sistema recebe energia do meio na forma de calor. Processo exotérmico: o sistema libera energia para o meio na forma de calor. O calor é um “processo” e não uma “entidade”, ou seja, o calor é a transferência de energia devido a uma diferença de temperatura. Energia interna E: a soma de toda energia potencial e cinética dos componentes de um sistema. Energia cinética: a energia que um corpo possui devido ao movimento. Energia potencial é a energia armazenada que surge das atrações e repulsões que um corpo experimenta em relação a outro corpo. Energia cinética e potencial se interconvertem de forma a conservar a energia total. 1 J = 1 Kg.m2/s2; 1 caloria é a energia necessária para subir a temperatura de 1 g de massa de 14,5 °C para 15,5 °C. 1 cal = 4,184 J. Efinal – Einicial = ΔE = q + w: calor “q” e trabalho “w” são as formas pelas quais o sistema ganha ou perde energia. Apenas ΔE (variação da energia interna) do sistema é mensurável, por meio das medidas de “q” e/ou “w”. W ou q > 0: trabalho (w) realizado pelo ambiente sobre o sistema, ou calor (q) absorvido pelo sistema, que aumentam sua energia interna “E” (processo endotérmico) e, desta forma, sua capacidade de realizar trabalho; w ou q < 0: trabalho realizado pelo sistema sobre o ambiente, ou calor (q) liberado do sistema para o ambiente, e diminuem sua E (processo exotérmico). Primeira lei da termodinâmica: a energia interna de um sistema isolado é constante.
- 3. 3 Expressão matemática da primeira lei: ΔE = q + w. A energia interna no nível molecular: o teorema de equipartição estima a contribuição do movimento das moléculas para a energia interna do sistema. As moléculas possuem graus de liberdade de movimento: vibração, rotação e translação, cujas contribuições quadráticas para a E são iguais a 1/2kT. Para o movimento em três dimensões: 3x1/2kT = 3/2NkT ou 3/2nRT (sabendo que R = Nak e N = nNa). Para um gás monoatômico perfeito Em(T) = Em(0) + 3/2RT (há somente translação), em que Em(0) = E em T = 0 (ausência de movimento). No caso de moléculas, introduz-se a contribuição quadrática dos movimentos de rotação: ▪ Molécula linear: Em(T) = Em(0) + (2 x 1/2kT (rotações) + 3/2kT (translação 3D) = Em(0) + 5/2RT. ▪ Molécula não linear: Em(T) = Em(0) + (3 x 1/2kT (rotações) + 3/2kT (translação 3D) = Em(0) + 3RT. Para que a temperatura de um mol de moléculas não-lineares aumente na mesma magnitude que um gás monoatômico, é necessário aplicar o dobro de energia. Tipos de trabalho: expansão, elétrico, extensão de uma mola, etc. Trabalho de expansão Quando um gás se expande contra uma força de oposição (a pressão externa) ele realiza trabalho de expansão: w = - pexAd = - pexΔV, onde A = área do pistão, p = pressão e d = distância de deslocamento do pistão. “A” vezes “d” = volume “V”. Esta fórmula é válida para pressão externa constante.
- 4. 4 EXERCÍCIO 1 a. Um gás expande 500 mL contra uma pressão externa de 1,2 atm, sem haver troca de calor. Quanto trabalho o gás realiza nesta expansão? Qual a mudança de energia interna do sistema? b. A água se expande quando congela. Quanto trabalho realiza 100 g de água sobre as paredes de um cano que exerce um pressão de oposição de 1070 atm, ao congelar a 0 °C? As densidades da água e do gelo a 0°C são 1,00 g.cm-3 e 0,92 g.cm-3, respectivamente. (Resposta: w = - 0,86 kJ). c. O gás nos quatro cilindros do motor de um carro expande de 0,22 L para 2,2 L em um cliclo. Assumindo que as engrenagens exercem uma pressão constante de 9,60 atm sobre o gás, quanto trabalho o motor realiza em um ciclo de combustão? Processo reversível: pode ser revertido ao estado original por uma mudança infinitesimal em uma variável (pressão, temperatura ou volume): pressão interna do gás e pressão externa estão em equilíbrio, ou diferem infinitesimalmente, a cada estágio da expansão. O trabalho realizado no processo reversível é a área total sob a curva no gráfico: dw = - pexdV (trabalho realizado em um estágio da expansão) pex = p dw = - pdV
- 5. 5 dw = - (nRT/V)dV Trabalho total realizado por todos os estágios de expansão: Processo irreversível: expansão contra uma diferença de pressão externa mensurável (grande) da pressão interna do gás. Ao aumentar infinitesimalmente pex, por exemplo, não converte a expansão em compressão. O processo ocorre em um único estágio (expande de uma vez). O gás realiza menos trabalho ao expandir irreversivelmente, pois a pressão externa neste processo é sempre menor do que a pressão externa em cada estágio no processo reversível. EXERCÍCIO 2 a. Um pistão confina 0,100 mol de Ar(g) em um cilindro de 1,00 L, a 25 °C. Dois experimentos são realizados: (1) O gás expande por um espaço de mais 1,00 L contra uma pressão externa constante 1,00 atm; e (2) O gás expande reversívelmente e isotermicamente até o mesmo volume final. Em qual processo o gás realiza mais trabalho? Prove. b. Um cilindro de 2,00 L de volume contém 0,100 mol de He(g) imerso em um banho de água a temperatura constante de 30 °C. Em qual processo o sistema realiza mais trabalho: expansão isotérmica até um volume final de 2,4 L contra uma pressão externa constante de 1,00 atm, ou ao expandir reversível e isotermicamente até o mesmo volume final? c. Calcule o trabalho realizado quando 50g de ferro reage com ácido clorídrico para produzir FeCl2(aq) e hidrogênio em (1) um recipiente fechado, de volume fixo; e (2) um béquer aberto a 25 °C.
- 6. 6 Funções de estado, como energia interna, volume e pressão, não dependem do caminho seguido pelo processo, apenas das condições que definem o atual estado (temperatura, pressão, massa, etc.), e ΔE depende, então, apenas do estado inicial e final: Um gás pode ser expandido de um volume inicial de 10 L a um volume final de 20 L por dois processos (caminhos) diferentes: expansão contra o vácuo (ΔE = w = q = 0) ou isotérmica (ΔE = - w = + q). Em ambos os casos, ΔE = 0, mas w e q são diferentes. Calor e trabalho não são funções de estado. Dependem, portanto, do caminho, ou do processo de mudança de estado do sistema. Calorimetria Expressão geral para a mudança infinitesimal de energia interna do sistema: dE = dq + dwexp + dwe Onde dwe é o trabalho extra, de não-expansão. Um sistema mantido a volume constante não realiza trabalho, portanto, dE = dq, ou para uma quantidade mensurável de energia, ΔE = qv (qv = mudança de estado a volume constante). Ao medir esta quantidade de calor, qv, liberada ou absorvida, medimos a mudança de energia interna do sistema: A quantidade de calor é medida pela variação de temperatura, com a bomba calorimétrica mantida em um banho adiabático de água: ΔE = q = CvΔT, onde Cv é a capacidade calorífica da bomba calorimétrica.
- 7. 7 Slope of E versus T at constant V: inclinação de E versus T a V constante: a inclinação desta curva em qualquer E e T, a V constante, é igual à derivada parcial Cv = (∂U/∂T)VdT dE = CvdTou ΔE = q = CvΔT (a variação de temperatura que o sistema tem de sofrer para ganhar ou perder 1 J de calor, a volume constante). Entalpia Uma nova função de estado: entalpia é igual à energia transferida (do sistema ou para o sistema) na forma de calor, quando a pressão é constante. H = E + pV, onde E = energia interna, pV = trabalho de expansão. Para uma mudança de estado infinitesimal no sistema: dH = dE + pdV + Vdp dH = (dq + dw) + pdV + Vdp Considerando que o sistema realiza apenas trabalho de expansão dw = -pdV: dH = dq – pexdV + pdV + Vdp dH = dq + Vdp Impondo a condição de que o processo ocorre a pressão constante (Vdp = 0): dH = dq Variação da entalpia com temperatura: capacidade calorífica a pressão constante Cp
- 8. 8 Cp = (∂H/∂T)PdT Assim, dH = CpdTou ΔH = CpΔT (a pressão constante) Sendo ΔH = qp, qp = CpΔT (a variação de temperatura que o sistema tem de sofrer para ganhar ou perder 1 J de calor, a volume constante). Capacidades caloríficas são propriedades extensivas: 100 g de água possui 100 vezes a capacidade calorífica de 1 g de água. Energia interna de um sistema (U) é a soma das energias cinética e potencial das partículas que constituem um gás ΔH é a transferência de energia medida em reações químicas que ocorrem a pressão constante (recipiente aberto à atmosfera). ΔH > 0, processo endotérmico; ΔH < 0, processo exotérmico. A variação de energia que acompanha os processos de mudança de estado físico também são medidas como entalpia (entalpia de vaporização ΔHvap, solidificação ΔHsol., etc.). As capacidades caloríficas são relacionadas pela expressão: Cp – Cv = nR ou Cp = nR + Cv A capacidade calorífica a pressão constante (Cp) é maior do que aquela a volume constante (Cv) porque parte da energia ganha pelo sistema é perdida como trabalho no processo a pressão constante (em que o volume é variado). Assim, ΔT neste processo é menor. EXERCÍCIO 3 a. A mudança de energia interna molar quando carbonato de cálcio, na forma de calcita, converte-se em aragonita, é de +0,21 kJ mol-1. Calcule a diferença entre as variações de entalpia molar e energia interna quando a pressão é de 1,0 bar, dado que as densidades dos polimorfos são de 2,71 g cm-3 e 2,93 g cm-3, respectivamente. Usa-se p(densidade) = M/Vm, onde M = massa molar e Vm = volume molar. o Lembrando que ΔH = ΔU + pΔV, a diferença ΔH – ΔU = -0,28 Pa m3 mol-1 é muito pequena em sistemas condensados (sólidos), mas a pressões muito altas, o termo pΔVm não pode ser desprezado. o A entalpia de um gás perfeito pode ser relacionada à sua energia interna através da expressão dos gases ideais pV = nRT ΔH = ΔU + pΔV ΔH = ΔU + ΔnRT b. Água é aquecida até a ebulição a uma pressão externa constante de 1,0 atm. Quando uma corrente elétrica de 0,50 A de uma fonte de 12 V passa por uma resistência, durante 300
- 9. 9 segundos, em contato térmico com a água, 0,798 g de água é vaporizada. Calcule a variação de energia interna molar ΔEm e entalpia ΔHm no ponto de ebulição (100 °C). Obs.: 1 Ampére x 1 Volt x 1 segundo = 1 J. o A energia interna é um pouco menor do que a entalpia (38 < 41 kJ mol-1), devido ao trabalho realizado pelo vapor de água, ao evaporar, expandindo-se contra a pressão atmosférica externa. Termoquímica As trocas de energia envolvidas nas reações químicas é a variação de entalpia, quando ocorrem a pressão constante, como na maioria dos casos. A entalpia padrão é igual à energia transferida na forma de calor a pressão constante. O estado padrão de uma substância em uma dada temperatura (geralmente a 298,15 K) é sua forma pura a 1 bar de pressão (1 bar = 100 000 Pa = 0,987 atm). Equação termoquímica: ΔvapH° = entalpia padrão de vaporização. Entalpias padrão de reações químicas (quando os reagentes e produtos estão na forma pura, nas condições padrão – 1 bar de pressão e 298,15 °C): Cálculo da variação de entalpia padrão que acompanha uma reação química: Para uma reação química qualquer A + B → C + D: A mudança de energia “total” que acompanha um processo que ocorre por um caminho indireto é a mesma quando o processo ocorre por um caminho direto.
- 10. 10 Lei de Hess: A entalpia padrão de uma reação global é igual à soma das entalpias padrão das reações individuais em que a reação global é dividida. EXERCÍCIO 4 a. A entalpia padrão de reação da hidrogenação do propeno é -124 kJ mol-1. A entalpia padrão de reação da combustão do propano é -2220 kJ mol-1. Calcule a entalpia padrão da combustão do propeno. Atkins, pág. 69.
- 11. 11 A energia interna é uma função de estado que depende das varíaveis p (pressão), V (volume) e T (temperatura). Ao escrever a energia interna em função de V e T: A derivada parcial (∂U/∂T)V é a capacidade calorífica a volume constante (Cv). A outra derivada (∂U/∂V)T é chamada de pressão interna, πt. dU pode então ser escrita como: Joule realizou um experimento para provar que, para um gás ideal, πt = 0, porém, para um gás real, a pressão interna depende das interações intermoleculares. A energia interna de um gás ideal não depende do volume.
