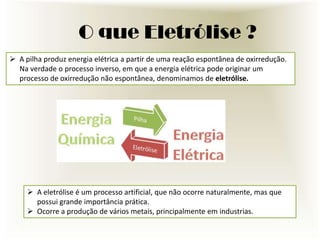
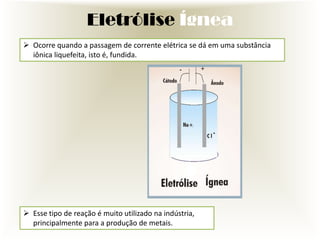
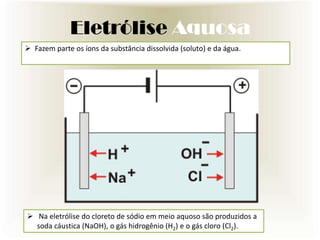
O documento descreve o processo de eletrólise, incluindo seus tipos principais (ígnea e aquosa), suas reações químicas e suas utilidades industriais e comerciais. A eletrólise é um processo no qual a energia elétrica causa reações químicas não espontâneas. Ela é amplamente usada na indústria para produzir metais e outros produtos químicos como cloro, hidrogênio e soda cáustica.