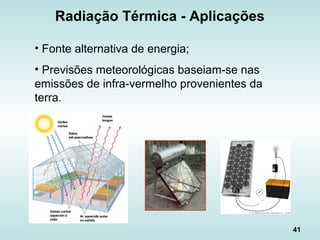
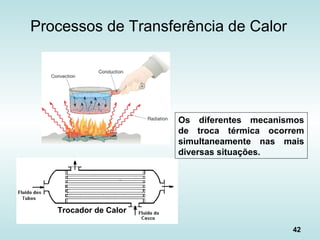
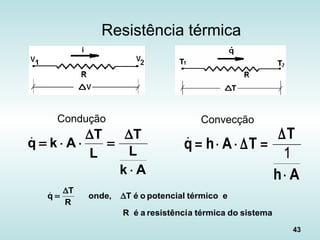
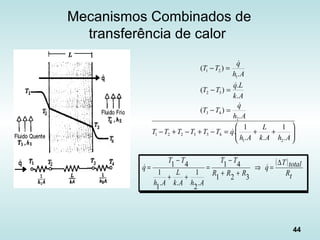
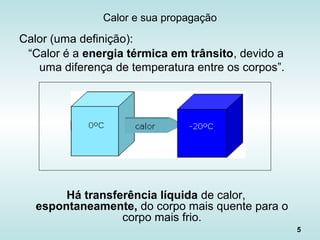
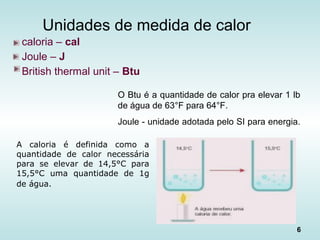
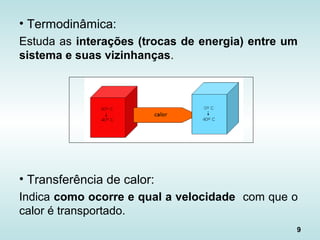
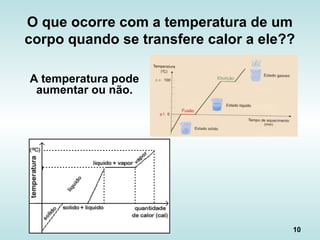
O documento discute os fundamentos da ciência térmica, definindo termos como energia, matéria e os principais estados da matéria. Explora os conceitos de temperatura, calor, transferência de calor por condução, convecção e radiação. Detalha os processos de troca de calor sensível e latente entre corpos.




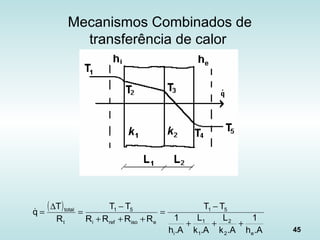
![11
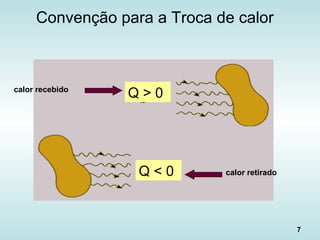
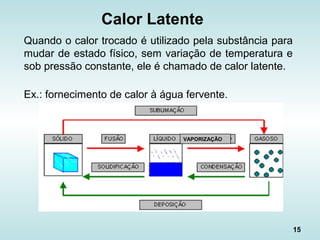
Calor sensível
Quando o calor é utilizado pela substância apenas para
variar sua temperatura, sem alterar seu estado físico.
Ex.: aquecimento da água numa panela antes da fervura.
Q = C ∆T = m c ∆T
Q = quantidade de calor trocado [J, cal, kcal, BTU etc];
C = capacidade calorífica do corpo [J/ºC];
m = massa do corpo [g, kg];
c = calor específico da substância [J/(kg ºC)];
∆T = variação da temperatura (Tfinal - Tinicial) [K, ºC].](https://image.slidesharecdn.com/aulatccefet-161006150208/85/Aula-tc-cefet-11-320.jpg)
![12
H2O Barra de
ferro
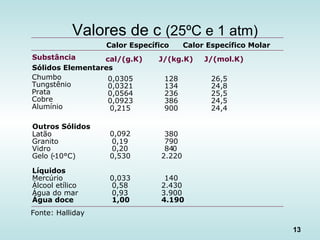
Calores específicos
(a 25ºC e 1 atm) [J/(kg ºC]:
H2O = 4200; Gelo (0ºC) =2040
Etanol = 2400; Alumínio = 900;
Cobre = 390; Latão = 380;
Ferro = 450; Vidro = 840.
Calor específico e capacidade
calorífica](https://image.slidesharecdn.com/aulatccefet-161006150208/85/Aula-tc-cefet-12-320.jpg)



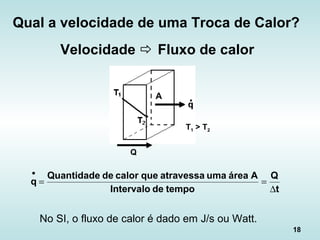

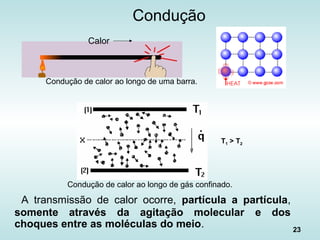
![24
Fluxo de Calor na Condução
• “Lei de Fourier”:
L
)TT(A
kqcond
21 −⋅
⋅=
•
k é a condutividade térmica [W/(m ºC)]
k (Fe a 300K) = 80,2 W/(m ºC)
k (água a 300K) = 5,9 x 10-1
W/(m ºC)
k (ar a 300K) = 2,6 x 10-2
W/(m ºC)](https://image.slidesharecdn.com/aulatccefet-161006150208/85/Aula-tc-cefet-24-320.jpg)

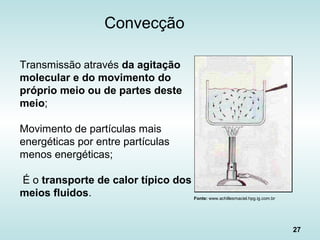
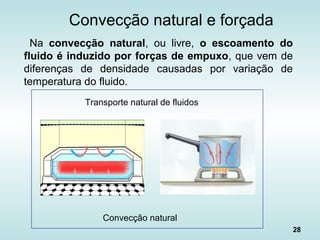
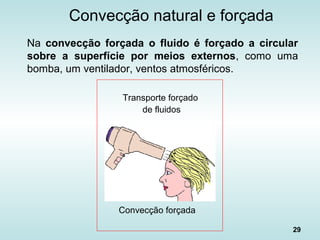
![30
Fluxo de Calor na Convecção
• “Lei de Newton do Resfriamento”:
)TT(Ahq sconv ∞
•
−⋅⋅=
- h é o coeficiente de transferência convectiva
de calor ou coeficiente de película [W/(m2
ºC)]
Área A](https://image.slidesharecdn.com/aulatccefet-161006150208/85/Aula-tc-cefet-30-320.jpg)
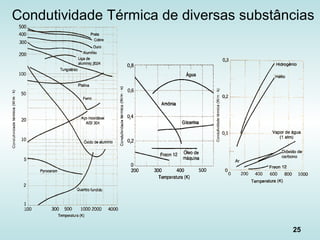
![31
Coeficiente de transferência
de calor por convecção - h
Processo h [W/(m2
K)]
Convecção natural
Gases
Líquidos
2 – 25
50 – 1.000
Convecção forçada
Gases
Líquidos
25 – 250
50 – 20.000
Convecção com mudança de fase
Ebulição ou condensação 2.500 – 100.000
Fonte: Incropera](https://image.slidesharecdn.com/aulatccefet-161006150208/85/Aula-tc-cefet-31-320.jpg)

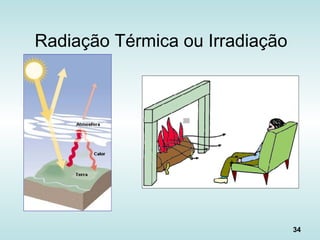
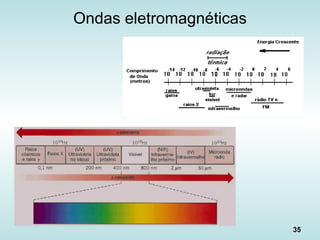
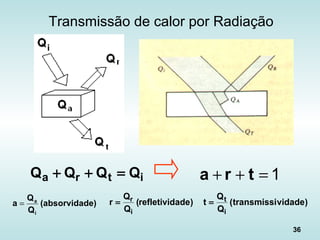


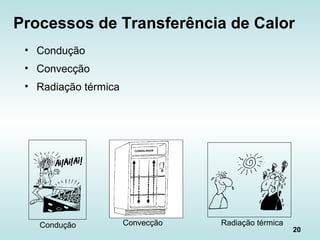
![39
Fluxo de calor na Radiação
“Lei de Stefan-Boltzmann”:
reais)(corpos
negro)(corponegro)(corpo
4rad
4
máxima
rad
T
A
q
E
T
A
q
E
⋅σ⋅ε=
=
⋅σ=
=
•
•
E – Poder emissivo [W/m2
];
ε – emissividade (0 ≤ ε ≤ 1);
σ – Constante de Stefan-Boltzmann [5,7 x 10-8
W/(m2
K4
)];
T – Temperatura absoluta do corpo (K).](https://image.slidesharecdn.com/aulatccefet-161006150208/85/Aula-tc-cefet-39-320.jpg)