O documento resume os principais pontos sobre a tabela periódica, incluindo:
1) Uma breve história da tabela periódica desde as primeiras tentativas no século XIX até a versão atual baseada no número atômico;
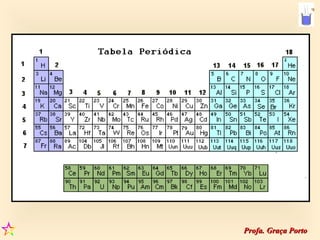
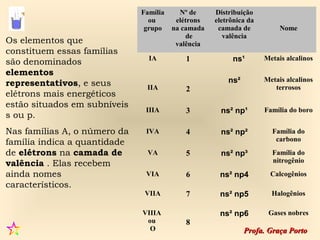
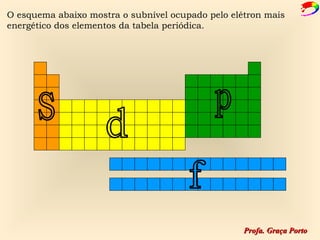
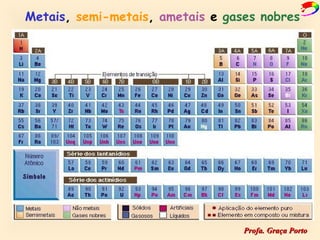
2) A organização atual da tabela periódica em períodos e grupos com base no número atômico;
3) As propriedades químicas dos elementos em cada grupo.