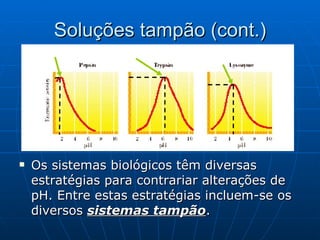
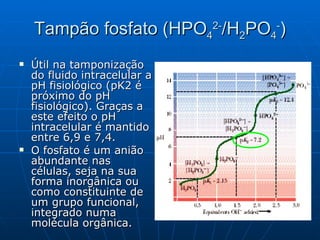
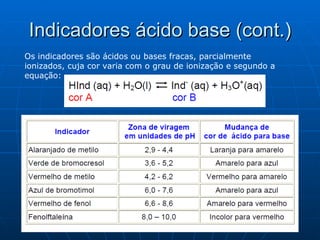
O documento discute soluções tampão e sua importância para sistemas biológicos. Sistemas tampão, como o par ácido-base conjugado, ajudam a manter o pH dentro de valores adequados para garantir o bom funcionamento de células e órgãos. O documento também descreve como preparar soluções tampão usando o exemplo do ácido acético e discute outros sistemas tampão importantes como o fosfato e o bicarbonato.






![Preparar uma solução tampão (cont.) Podemos então, para pH = 5, utilizando a eq. de Henderson-Hasselbalch, calcular a relação entre as concentrações da forma ácida (CH 3 COOH)=HA e da sua base conjugada (CH 3 COO - )=A - : pH = pKa + log([A - ]/[HA]) 5 = 4,76 + log([A - ]/[HA]) log([A - ]/[HA]) = 0,24 [A - ]/[HA] = 1,74/1 [A-] [HA]](https://image.slidesharecdn.com/soluestampo-100824120611-phpapp02/85/Solucoes-tampao-8-320.jpg)
![Preparar uma solução tampão (cont.) O total das conc. relativas do ácido e base conjugada, a pH=5, é 1,74+1=2,74. Uma vez que a concentração total da nossa solução tampão é 0,2M, então, nessa situação específica, teremos: [CH 3 COO - ] = 0,2x1,74/2,74=0,127M [CH 3 COOH] = 0,2x1/2,74=0,073M Resumindo: Um tampão de ácido acético poderia ser usado para tamponar uma solução a pH=5 pq. pH≈pKa (4,76). A esse pH, para uma solução de ác. acético 0,2M, a concentração da forma protonada=0,073M e da sua base conjugada seria 0,127M. Para preparar 1 litro desta solução seria, assim, necessária uma massa de 0,127x82=10,41g de CH 3 COONa e 0,073x60=4,38g de CH 3 COOH. mM(CH 3 COONa)=82g/mol mM(CH 3 COOH)=60g/mol](https://image.slidesharecdn.com/soluestampo-100824120611-phpapp02/85/Solucoes-tampao-9-320.jpg)



![Tampão bicarbonato (cont.) A [H 2 CO 3 ] é mantida estável graças à disponibilidade do CO 2 , apesar da forte tendência para se transformar em HCO 3 - . A reacção de hidratação do CO 2 é catalizada pela enzima anidrase carbónica o que facilita e acelera a formação de H 2 CO 3 . Nas condições em que decorre, a reacção (2) tem o seu equilíbrio fortemente deslocado para a esquerda (há muito mais CO 2 (d) que H 2 CO 3 – 500:1) – este facto favorece a tendência para deslocar o equilíbrio da reacção (3) tb. para a esquerda.](https://image.slidesharecdn.com/soluestampo-100824120611-phpapp02/85/Solucoes-tampao-14-320.jpg)



![Tampão bicarbonato (cont.) Resumindo: Apesar de [H 2 CO 3 ] = 0,1.[HCO 3 - ], a pH=7,4, o que poderá supor um efeito tampão pouco eficiente, convém lembrar a contribuição do CO 2 (d) para a concentração da componente ácida (ver reacção de hidratação de CO 2 (d) ). O tampão de bicarbonato é um sistema aberto, contando para o seu funcionamento com o CO 2 proveniente dos pulmões. Acidose respiratória (hipoventilação) e alcalose respiratória (hiperventilação).](https://image.slidesharecdn.com/soluestampo-100824120611-phpapp02/85/Solucoes-tampao-18-320.jpg)
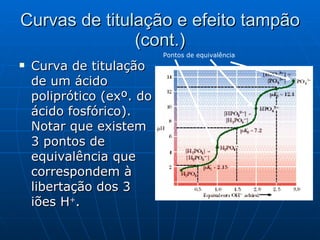
![Curvas de titulação e efeito tampão Curva de titulação de um ácido monoprótico (apenas pode libertar um ião H + ). Na zona mais plana da curva encontra-se o ponto em que [CH 3 COOH]=[CH3COO - ], correspondente ao pKa do ácido e à região de pH onde o efeito tampão é máximo. ? – Em que gama de pH poderia usar o ácido acético como tampão? Ponto em que [C H3COOH]=[CH3COO-] Zona de pH a que corresponde um maior efeito tampão](https://image.slidesharecdn.com/soluestampo-100824120611-phpapp02/85/Solucoes-tampao-19-320.jpg)

![Força iónica A força iónica é uma medida da quantidade de electrólitos (espécies químicas com carga positiva ou negativa) presentes em solução. O seu valor é dado por: I = ½ . ∑ [i] . z 2 mol/l [i]= concentração do electrólito z= carga iónica A carga iónica influi, frequentemente em conjunto com o factor pH e outros, no funcionamento de sistemas biológicos, nomeadamente ao nível dos processos de troca em que as membranas celulares estão envolvidas. Valor de força iónica fisiológica ≈ 0,20M.](https://image.slidesharecdn.com/soluestampo-100824120611-phpapp02/85/Solucoes-tampao-23-320.jpg)