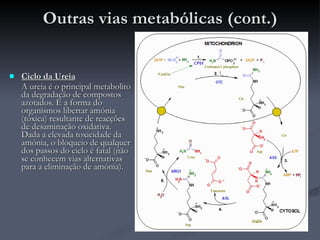
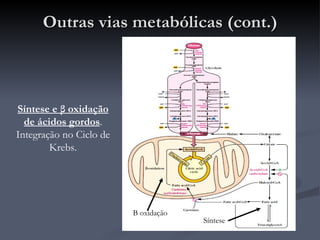
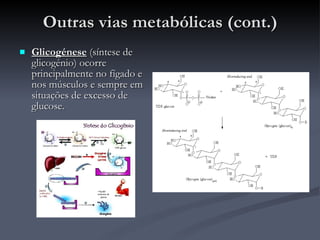
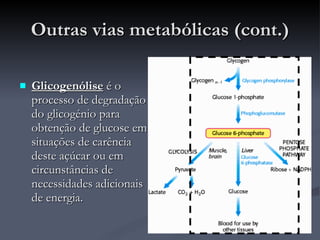
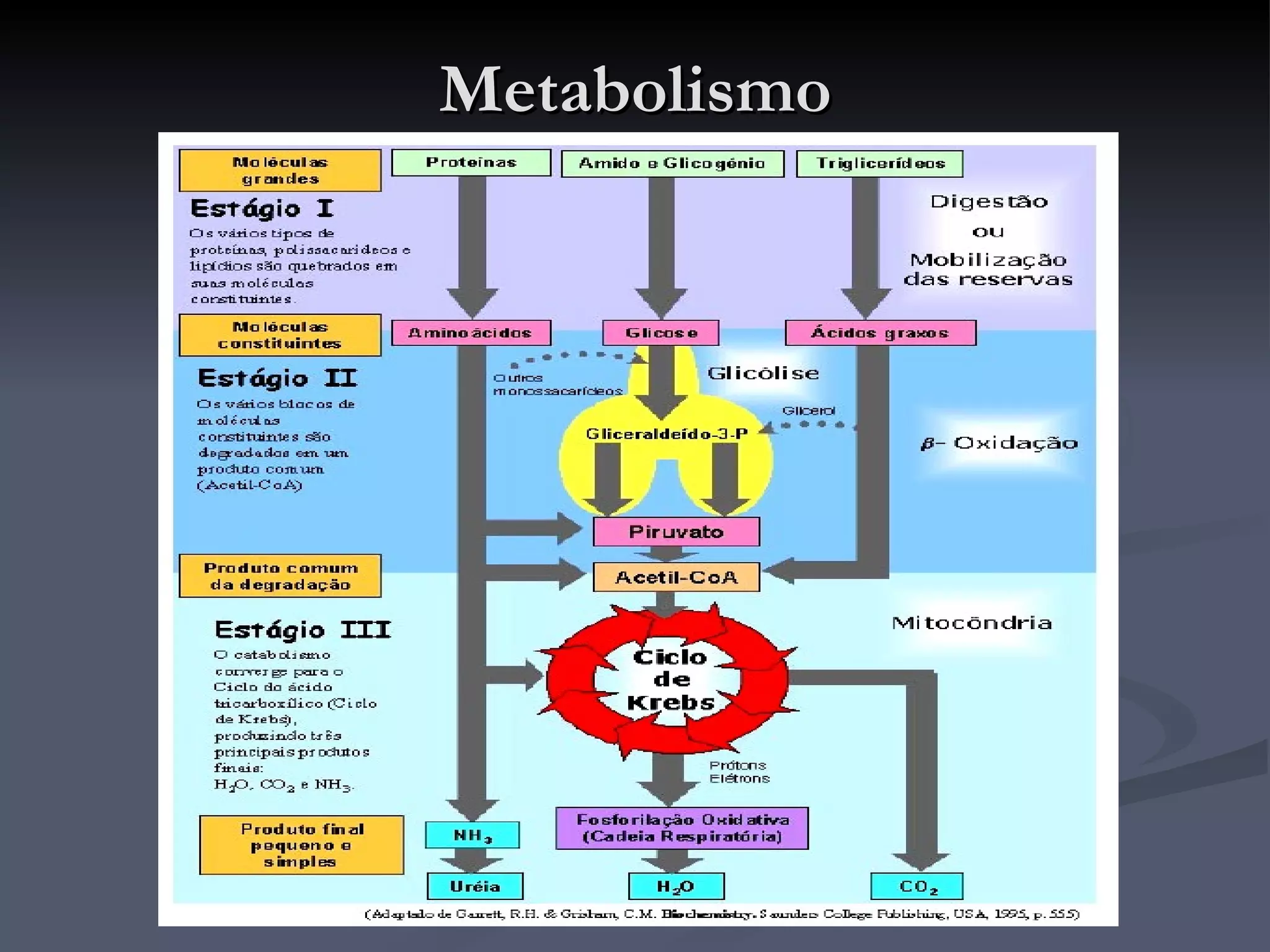
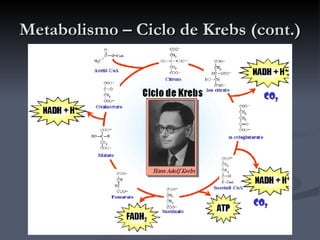
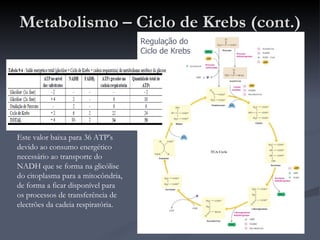
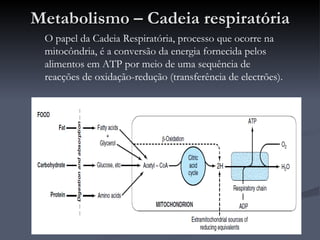
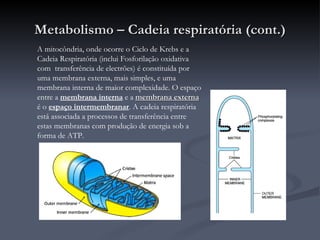
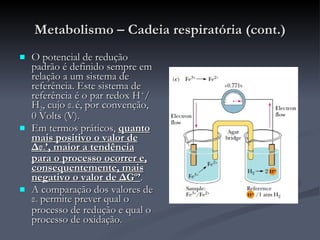
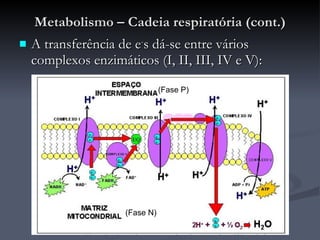
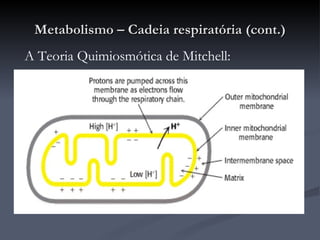
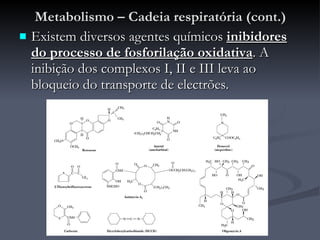
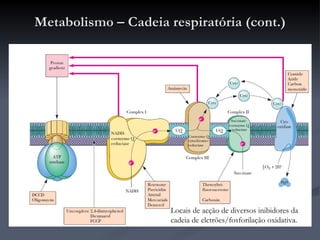
O documento descreve o ciclo de Krebs e a cadeia respiratória mitocondrial. O ciclo de Krebs converte acetil-CoA em oxaloacetato, gerando moléculas energéticas como NADH e FADH2. Estas moléculas transferem elétrons na cadeia respiratória, bombeando prótons através da membrana mitocondrial e gerando energia na forma de ATP.






















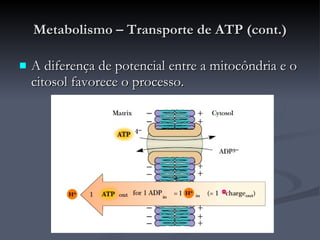

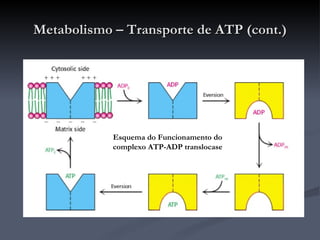


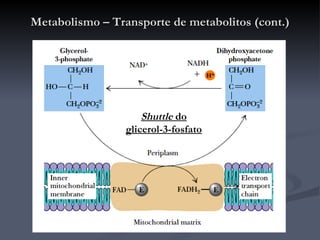
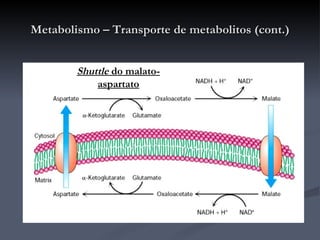
![Metabolismo – Transporte de metabolitos (cont.) Shuttle do malato-aspartato O oxaloacetato é reduzido a malato, no citosol, recebendo os e - s do NADH (passa a NAD + ). O malato é transportado através da membrana interna da mitocôndria onde é reoxidado por acção da malato-desidrogenase, convertendo o NAD + mitocondrial a NADH que rapidamente entra na cadeia de transporte de electrões. O oxaloacetato produzido é convertido em aspartato para que possa atravessar a membrana em direcção ao citosol, onde é de novo convertido em oxaloacetato. É um processo reversível que apenas ocorre se o quociente [NADH]/[NAD + ] for maior no citosol que na matriz. Como é aí produzido NADH o processo não envolve o consumo de energia (é motivado pelo gradiente de concentrações [NADH]/[NAD + ] entre o citosol e a matriz).](https://image.slidesharecdn.com/krebs-100824120259-phpapp02/85/Ciclo-de-Krebs-41-320.jpg)