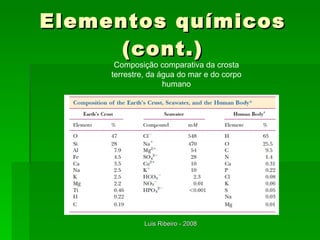
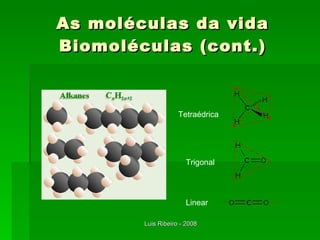
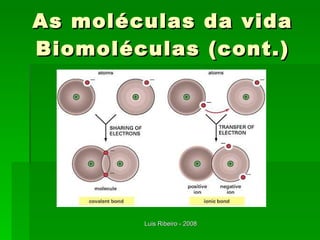
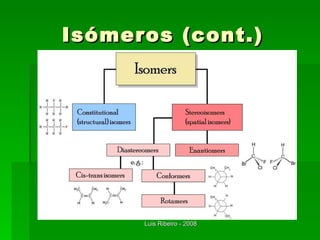
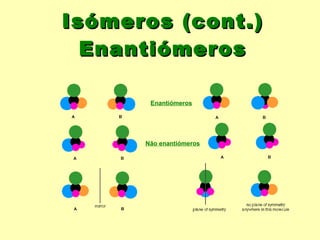
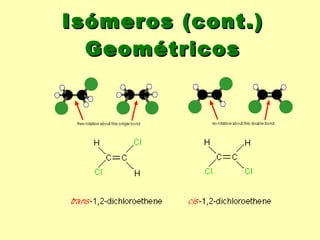
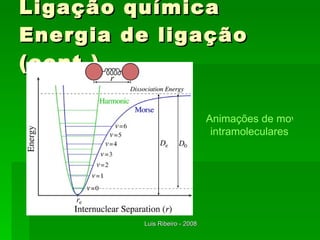
O documento descreve os principais conceitos da bioquímica, incluindo biomoléculas, elementos químicos, tabela periódica, átomos, ligações químicas, isômeros e grupos funcionais. Aborda os elementos mais comuns nos organismos vivos como carbono, hidrogênio, oxigênio e nitrogênio e suas propriedades para formar ligações estáveis.