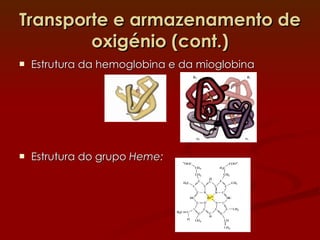
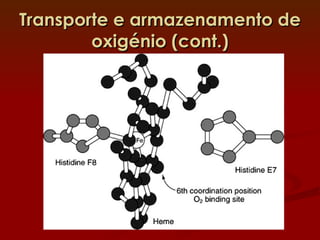
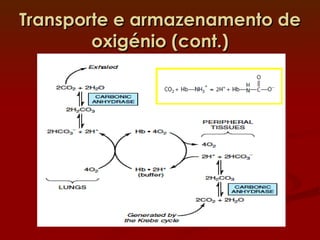
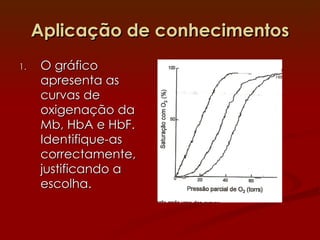
1) A hemoglobina e a mioglobina transportam e armazenam oxigênio no sangue e músculos, respectivamente, ligando-se ao íon ferro em seus grupos heme.
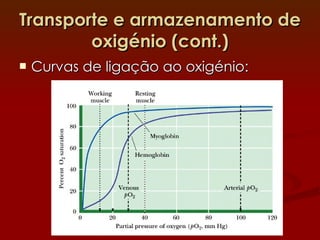
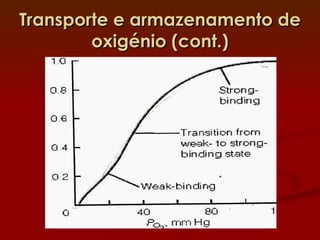
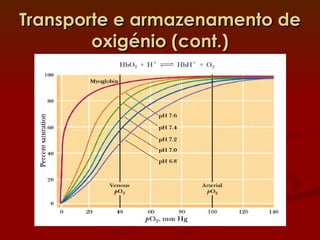
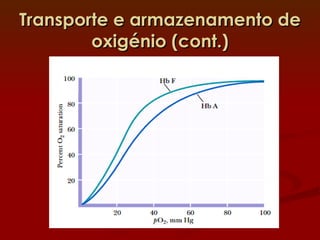
2) A hemoglobina tem estrutura tetramerica enquanto a mioglobina é um monômero. Isso afeta suas curvas de ligação ao oxigênio e funções de transporte vs armazenamento.
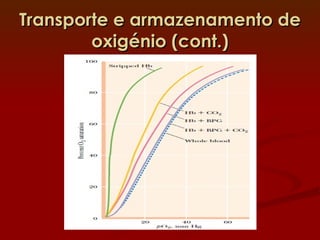
3) Diversos fatores como o pH, CO2 e o BPG regulam a afinidade da hemoglobina pelo oxigênio para permitir sua eficiente