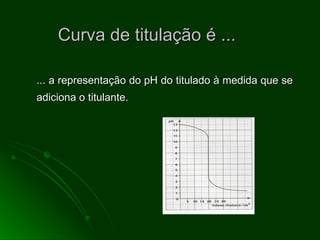
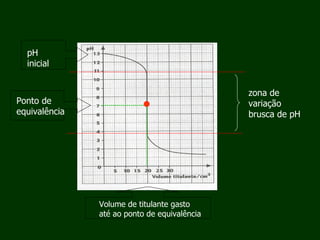
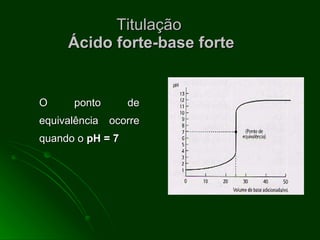
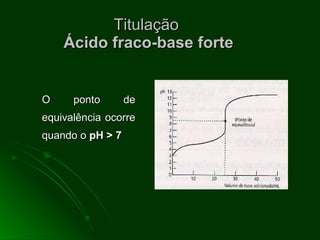
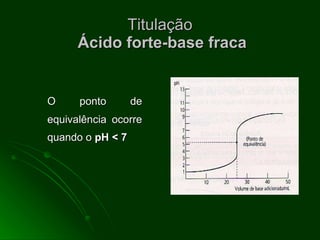
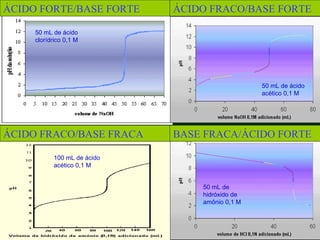
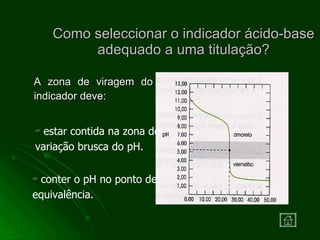
O documento aborda as titulações ácido-base, destacando suas vantagens e desvantagens, além de descrever diferentes métodos volumétricos, como titulação de oxidação-redução, precipitação e complexação. Explica ainda o processo de titulação, incluindo a determinação do ponto de equivalência e a utilização de indicadores. Além disso, discute as características de titulações com ácidos e bases fortes e fracas.