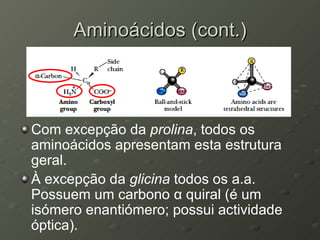
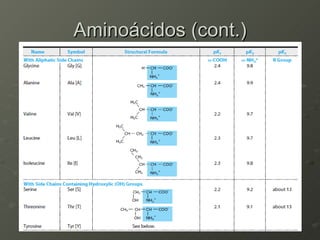
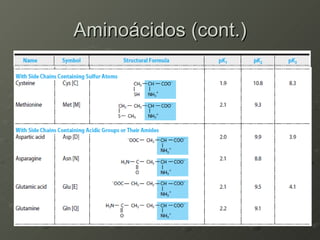
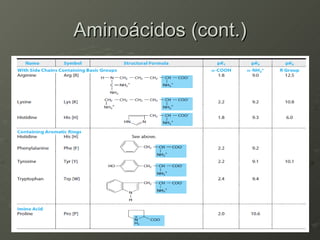
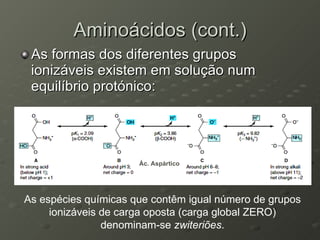
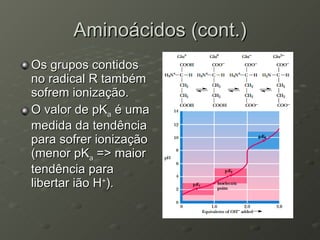
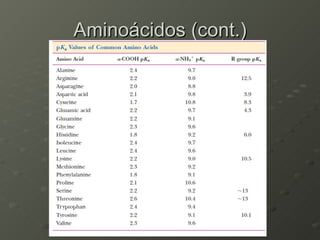
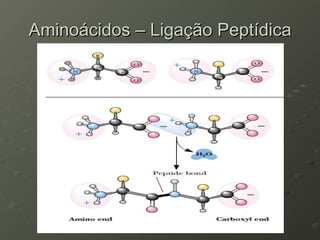
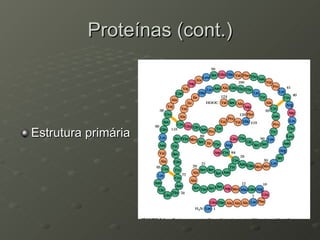
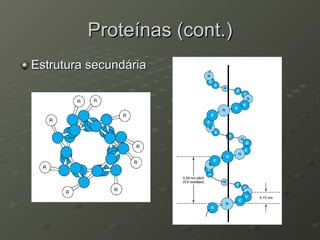
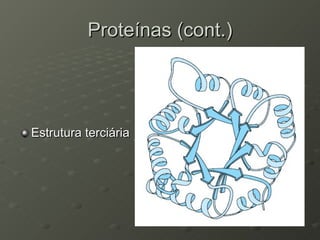
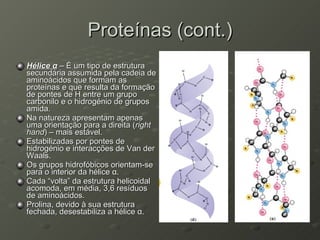
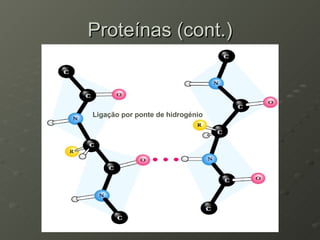
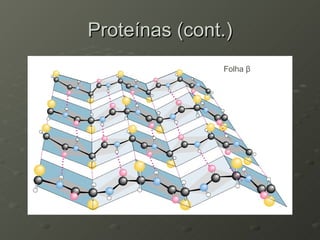
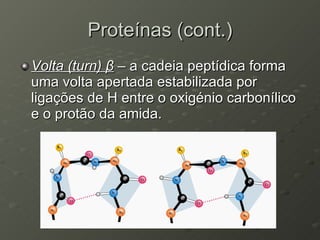
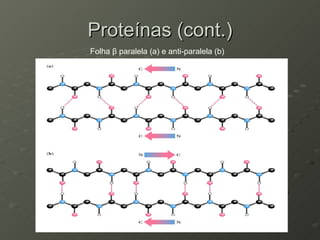
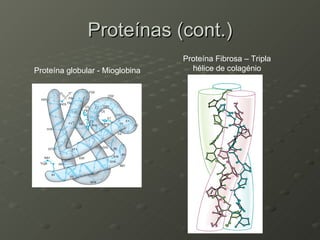
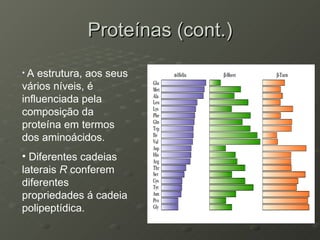
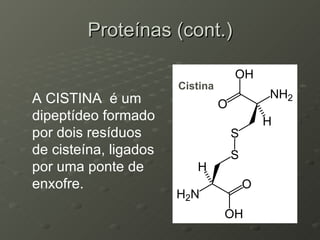
O documento descreve as propriedades dos aminoácidos e sua importância na estrutura e função das proteínas. Resume que aminoácidos são moléculas orgânicas que constituem as unidades estruturais das proteínas e participam de funções celulares. Existem 20 aminoácidos essenciais para humanos que devem ser ingeridos por meio da alimentação.