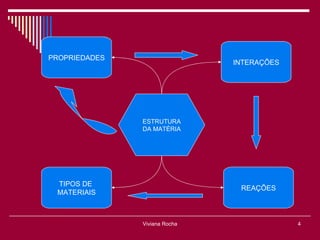
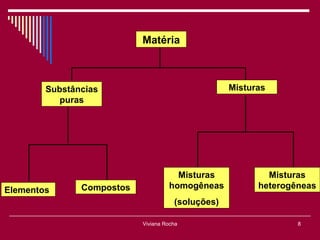
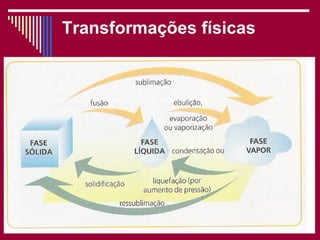
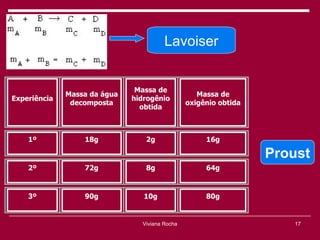
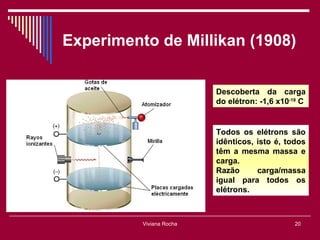
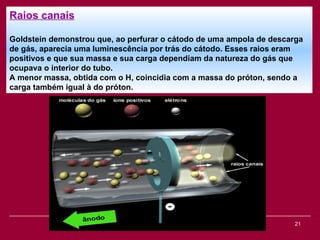
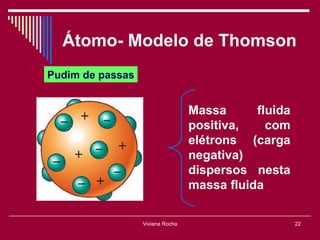
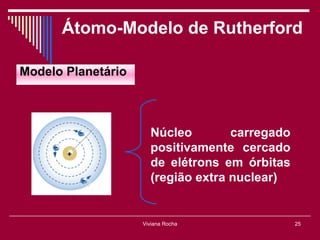
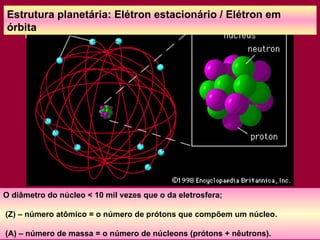
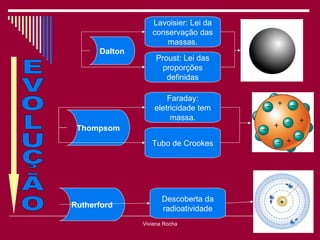
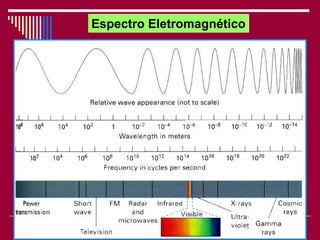
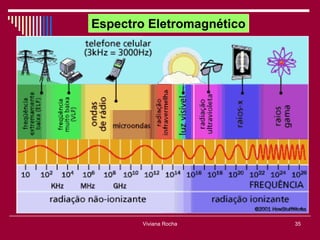
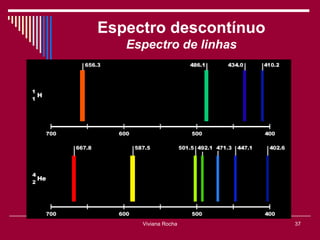
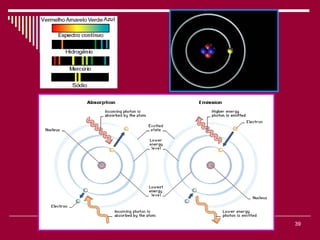
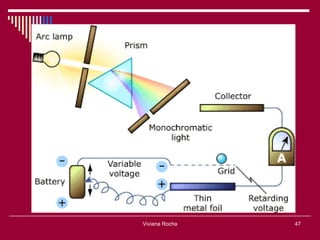
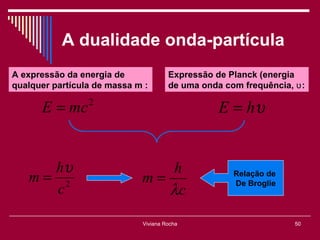
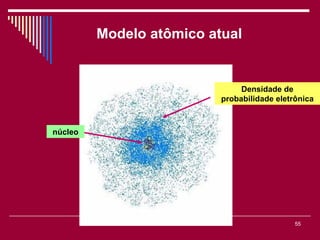
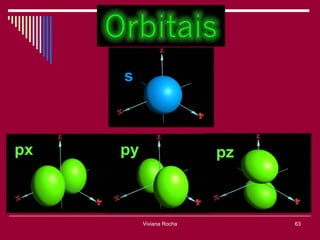
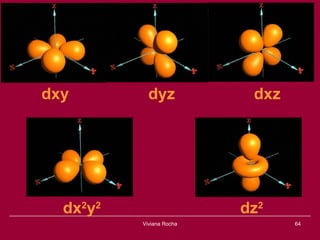
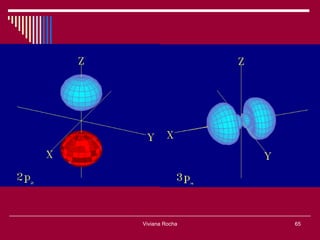
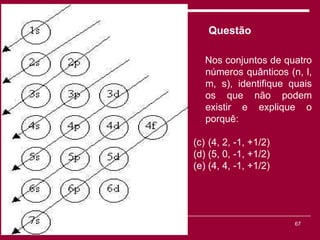
O documento discute os conceitos fundamentais da química, incluindo a evolução dos modelos atômicos de Dalton, Thomson, Rutherford e Bohr. Também aborda as transformações da matéria, propriedades das substâncias e misturas, e a metodologia científica.