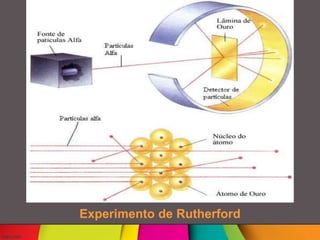
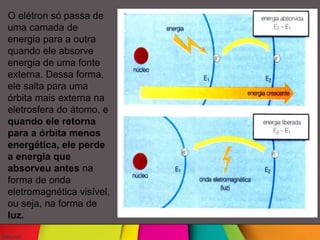
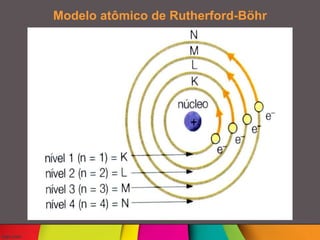
Niels Böhr foi um físico dinamarquês que desenvolveu o modelo atômico de Rutherford-Böhr, no qual os elétrons giram em órbitas definidas ao redor do núcleo atômico. Ele também postulou que os elétrons só podem existir em certos níveis de energia e saltam entre eles absorvendo ou emitindo quanta de energia. Böhr trabalhou com Rutherford na Universidade de Manchester e aperfeiçoou o modelo atômico proposto por Rutherford.