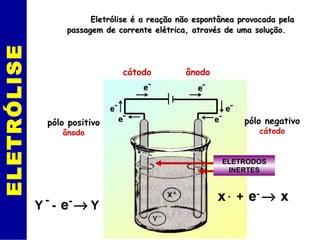
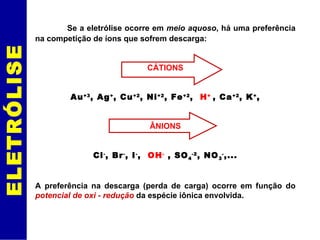
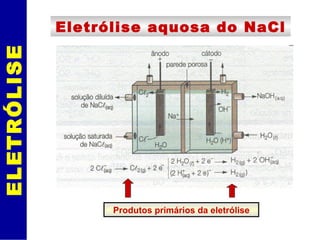
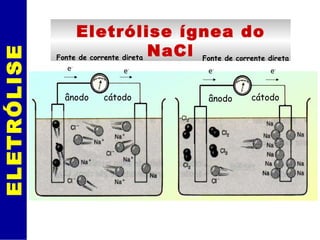
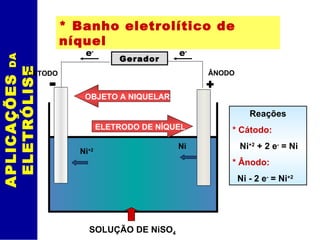
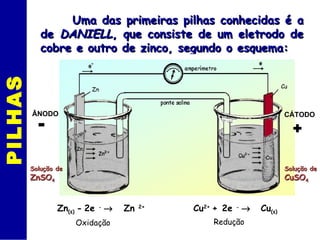
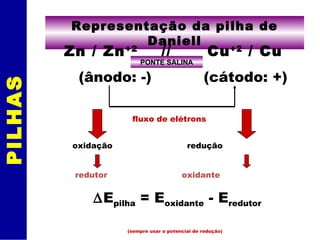
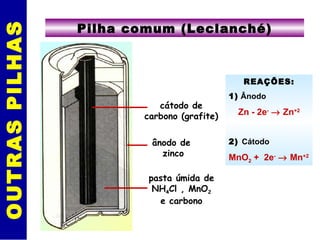
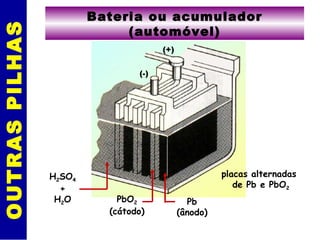
O documento discute eletrólise e pilhas eletroquímicas. Ele explica que a eletrólise envolve reações provocadas por corrente elétrica, enquanto pilhas geram corrente elétrica através de reações. A eletrólise ocorre nos eletrodos, com íons migrando para os polos e sofrendo oxidação ou redução. As leis de Faraday relacionam a carga elétrica com a massa de material produzido na eletrólise. Exemplos incluem a eletró