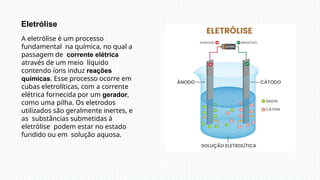
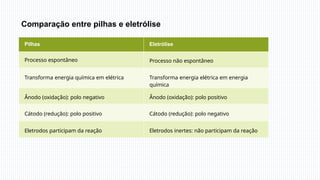
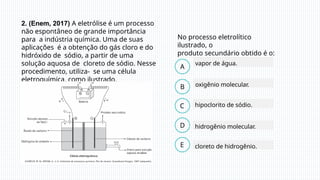
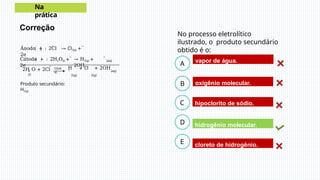
A eletrólise é um processo químico essencial que usa corrente elétrica para induzir reações em soluções líquidas ou substâncias fundidas, permitindo a separação de elementos químicos, como na produção de sódio metálico a partir do cloreto de sódio. Em eletrólise aquosa, a dissociação de íons e a prioridade de descarga determinam os produtos, como gás hidrogênio e gás cloro. A eletrólise tem grande importância industrial, sendo usada na fabricação de substâncias como cloro e hidróxido de sódio.