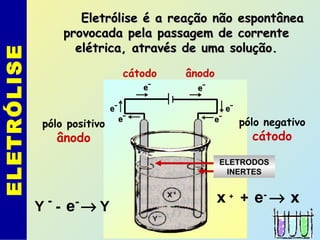
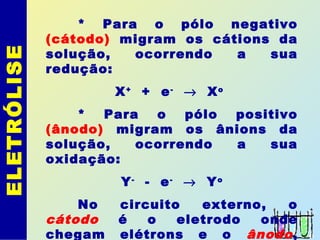
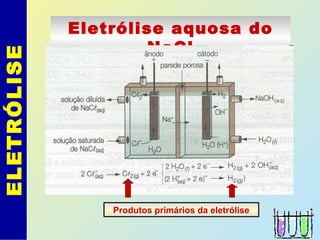
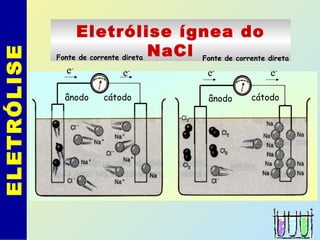
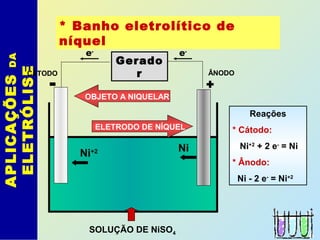
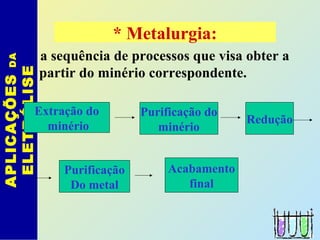
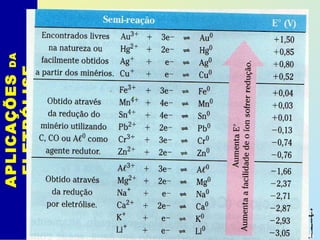
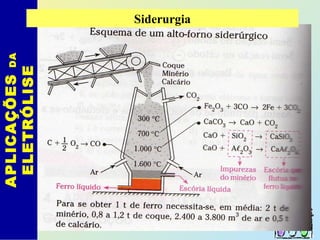
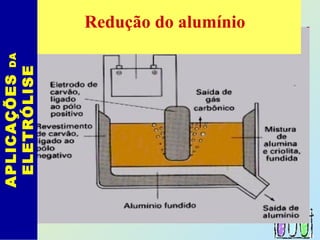
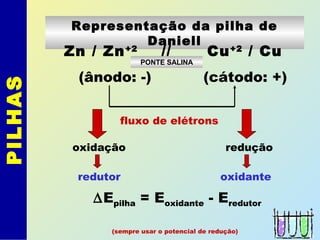
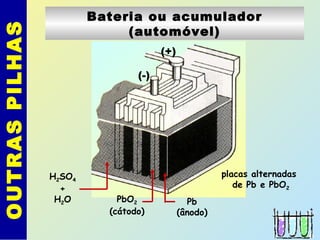
O documento descreve os principais conceitos de eletroquímica, abordando eletrólise e pilhas. A eletrólise é a decomposição de substâncias por corrente elétrica, enquanto as pilhas geram corrente elétrica a partir de reações eletroquímicas. Exemplos de aplicações incluem banhos eletrolíticos, obtenção de metais e a redução do alumínio. A pilha de Daniell é descrita como um exemplo inicial.