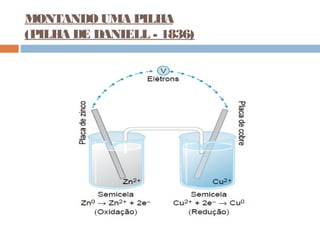
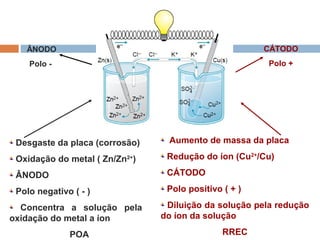
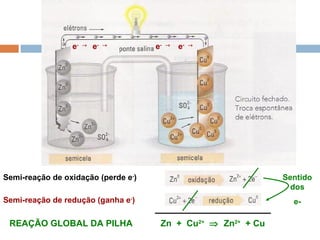
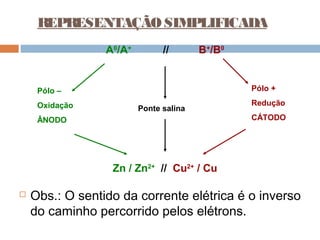
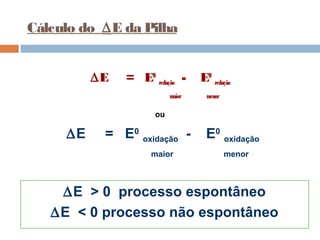
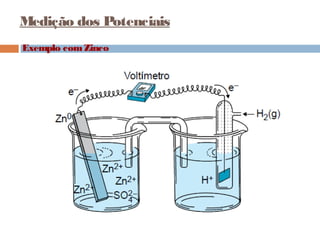
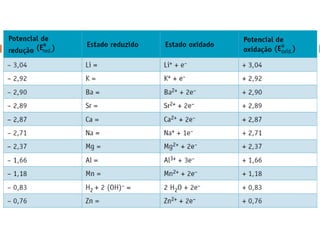
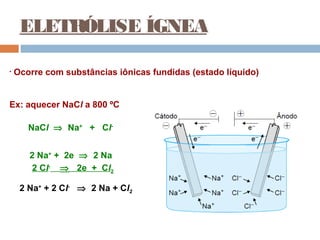
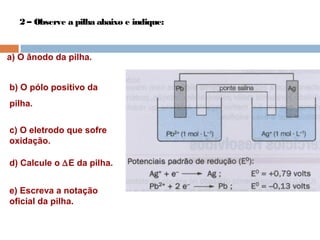
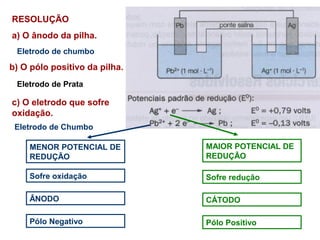
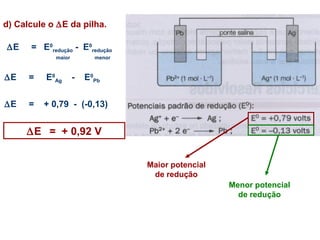
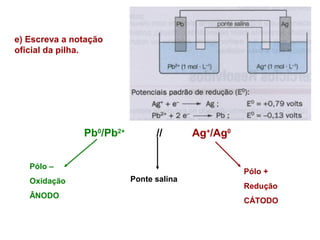
Pilhas elétricas convertem energia química em energia elétrica através de reações redox. Alessandro Volta construiu a primeira pilha empilhando discos de zinco e cobre separados por um eletrólito. Uma pilha típica contém dois eletrodos imersos em soluções eletrolíticas diferentes, ligados por um condutor por onde os elétrons fluem da reação de oxidação para a redução.