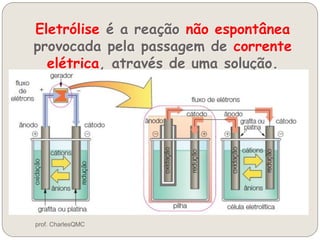
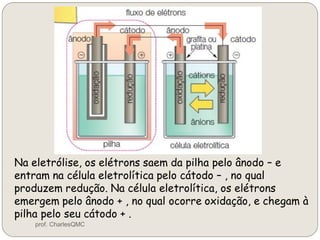
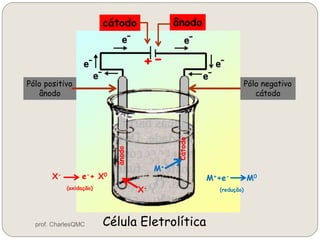
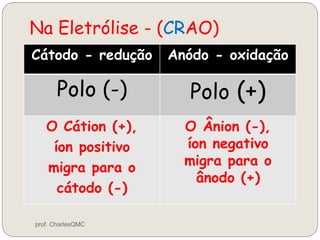
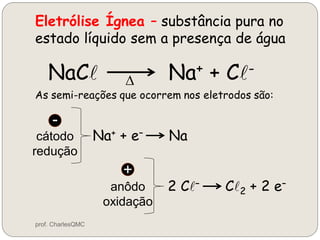
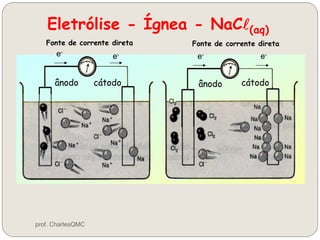
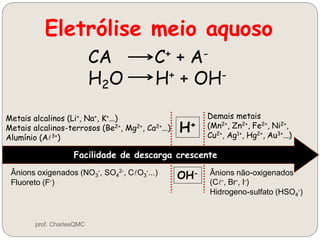
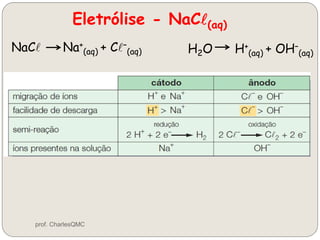
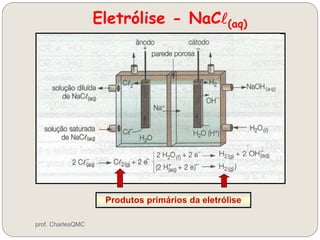
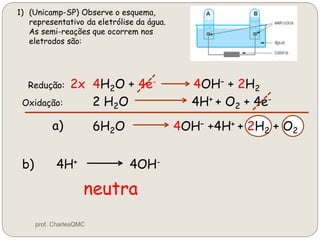
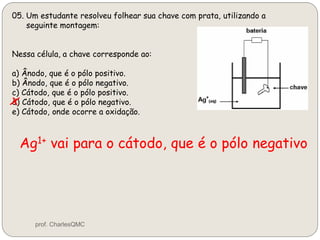
O documento discute eletrólise, que é uma reação não espontânea provocada pela passagem de corrente elétrica através de uma solução. A eletrólise ocorre quando os íons migram para os eletrodos, onde ocorrem as reações de oxidação no ânodo e redução no cátodo. A eletrólise de NaCl produz sódio metálico, cloro gasoso e outros produtos dependendo dos reagentes e condições.