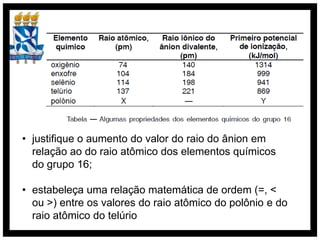
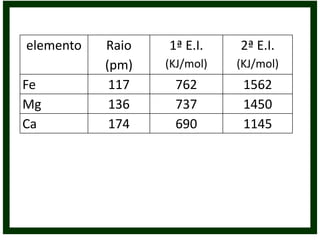
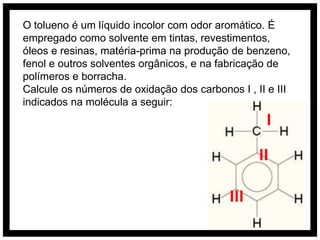
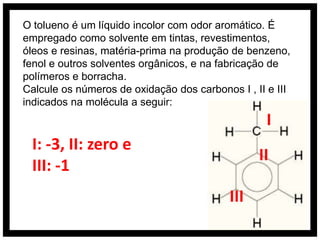
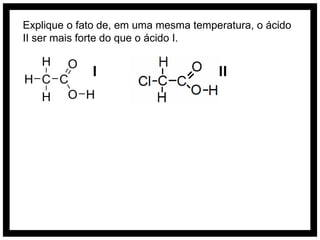
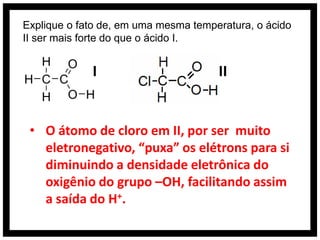
O documento discute conceitos de química orgânica e inorgânica, incluindo: (1) cálculos de números de oxidação em moléculas de tolueno; (2) explicação do aumento drástico da energia de ionização do alumínio entre a terceira e quarta remoção de elétrons; (3) justificativa de que o ácido clorídrico é mais forte que o ácido hidroxídrico devido à eletronegatividade do cloro.